
| A. | 标准状况下,相同体积的SO2和SO3,质量比为4:5 | |
| B. | 相同状况下,质量相同的O2和O3,密度之比为3:2 | |
| C. | 相同质量的金刚石和石墨含有相同的C原子数和共价键数 | |
| D. | 标准状况下,相同体积的C2H2和C2H4,密度比为13:14 |
分析 A.标准状况下三氧化硫的状态不是气态;
B.相同条件下,气体的密度与摩尔质量成正比;
C.金刚石中1molC形成2mol共价键,石墨中1molC均形成1.5mol共价键;
D.相同条件下气体的密度与摩尔质量成正比.
解答 解:A.标准状况下SO3不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.相同状况下,气体的密度与摩尔质量成正比,则O2和O3的密度之比=32g/mol:48g/mol=2:3,故B错误;
C.相同质量的金刚石和石墨中含有相同的碳原子数,金刚石中C原子与1其它4个C成键,1molC平均形成2mol共价键,石墨中C原子与其它3个C成键,1molC均形成1.5mol共价键,等质量时二者含有的共价键之比为4:3,故C错误;
D.标准状况下,气体的密度与摩尔质量成正比,则C2H2和C2H4的密度比=26g/mol:28g/mol=13:14,故D正确;
故选D.
点评 本题考查了物质的量的计算,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意掌握密度与摩尔质量之间的关系,C为易错点,注意明确金刚石和石墨的成键特点.


科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的最高正化合价等于它所处的族序数 | |
| B. | 主族族序数与价电子数相同 | |
| C. | 非金属元素在化合物中既可显正价又可显负价 | |
| D. | 所有非金属元素的负化合价等于使原子达到8电子稳定结构所需得到的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定条件下向体积为1L的密闭容器中充入1mol CH4和1mol H2O,测得CH4(g)和CO(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 10min时用CH4表示的反应速率为0.075 mol•L-1•min-1 | |
| B. | 使用高效催化剂能够增大CO的产率 | |
| C. | 该条件下反应的平衡常数为0.1875 | |
| D. | 升高温度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
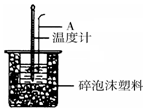 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置 中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、SO42-、NO3- | ||
| C. | Na+、H+、Cl-、CO32- | D. | K+、Cu2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亚铁溶液中通入氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 2 mol/L CaCl2溶液 | B. | 100 mL 2 mol/L NaCl溶液 | ||
| C. | 50 mL 4 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>Q>W | |
| B. | 最高价氧化物对应的水化物的酸性:Z<Q | |
| C. | Q和W可形成原子个数比为1:1和1:2的化合物 | |
| D. | X、Y和W三种元素形成的化合物的水溶液呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com