
| A.SiCl4、PCl5分子中各原子最外层均达到8电子稳定结构 |
| B.化学反应中能量变化的大小与反应物的质量多少无关。 |
| C.经实验测得邻-二溴苯仅一种结构,说明苯环结构中,不存在单双键交替结构 |
| D.需要加热才能发生的反应一定是吸热反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
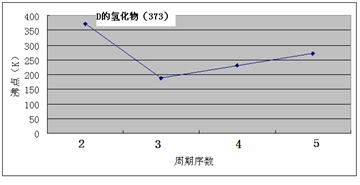
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H216O、D216O、H218O、D218O互为同素异形体 |
| B.有单质生成的反应一定是氧化还原反应 |
| C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF |
| D.电子层结构相同的不同离子,其半径随核电荷数的增大而减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
氧化剂或氯化剂,能与许多有机物反应。请回答下列问题: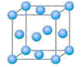
 分子的空间构型是_______。
分子的空间构型是_______。 成的合金。
成的合金。 态碳(C)原子的价电子排布式为 。
态碳(C)原子的价电子排布式为 。 )4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。
)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于 (填序号)。 种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中
种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式 。晶体中 每个镁原子周围距离最近的镍原子有 个。
每个镁原子周围距离最近的镍原子有 个。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2的化学性质比O2稳定 | B.HNO3易挥发,H2SO4难挥发 |
| C.常温、常压下,溴呈液态,碘呈固态 | D.稀有气体很难发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com