
����Ŀ��������(ά����K)��ֹѪ���ã�����ͨ��2���������������Ƶã���Ӧ�г����������������÷�Ӧ���ȣ��ɱ�ʾΪ��
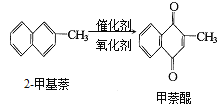
��ij�κϳɷ�Ӧ�У���1��4g��2�����������Ƶ�0��17g����������֪�ôκϳɷ�Ӧ�������ǿ�ģ����жϵ�������ʵ͵�ԭ����
A��ʹ���˹����������� B��û�������ᣬ����ʹ������������
C���ѷ�Ӧ�������� D�������ɵļ������dz�����

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2O2����������ȷ����(����)
A��1 mol Na2O2������CO2��Ӧת�Ƶĵ���Ϊ1 mol
B����10 g H2��CO�Ļ��������ȼ�գ���������(H2O��CO2)ͨ��������Na2O2�����г�ַ�Ӧ����������Ϊ10 g
C����Na2O2Ͷ��FeSO4��Һ�����ɺ��ɫ����
D���������ʵ�����NaHCO3��Na2O2��Ϻ����ܱ������г�ּ����ų������ʣ�����ΪNa2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����˶���ʹ�õĻ�������ܴ����Դ�ڱ����ȼ�գ�������һ��������ȼ�ϡ��Իش��������⣺
����ͼ��һ����������ȫȼ������CO2��1 mol H2O�����е������仯ͼ������ͼ�е���������������������������
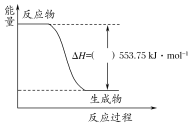
��д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��____________________________________________��
(2)2SO2��g��+O2��g��![]() 2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2��g������Ϊ1 mol SO3��g������H=��99 kJmol-1��
2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2��g������Ϊ1 mol SO3��g������H=��99 kJmol-1��
��ش��������⣺
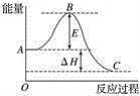
��ͼ����H=______kJmol-1��
����֪�������ȼ����Ϊ296 kJmol-1��������S��s������1 mol SO3��g������H=______ kJmol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ʯȼ�ϵ�˵���������( )
A. ʯ���к���![]() ������������ͨ��ʯ�͵ķ���õ�����
������������ͨ��ʯ�͵ķ���õ�����
B. ��![]() �������������;������ѻ����Եõ�����
�������������;������ѻ����Եõ�����
C. ��Ȼ����һ�����Ļ�ʯȼ�ϣ�����Ϊ����ԭ�ϣ���Ҫ���ںϳɰ��������״���
D. ú�к��б��ͼױ��������÷���ķ��������Ǵ�ú�з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��a��b��c��d��e��ԭ��������������b�ǵؿ��к�����ߵ�Ԫ�أ�e�ĵ��ʵ��۵���ͬ����Ԫ������ߣ�a��b��ԭ������֮�͵���e��ԭ��������dԭ�ӵĺ�����Ӳ��������������������ֱ���cdb2��Һ��c2eb3��Һ��ͨ������ab2������������������ͨ�����������Ķ��Թ�ϵ��������ͼ��ʾ������˵������ȷ����
A. ԭ�Ӱ뾶��c>d>e>a>b
B. ��ҵ��ͨ������ab���»�ԭd2b3�ķ���ұ��d�ĵ���
C. ͬ���£�0.1mol��L-1c2eb3��Һ��pH����0.1mol��L-1c2ab3��Һ
D. ���⻯������ȶ��ԣ�b>a>e
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ������ʯ�͵���Ҫ�л�����ԭ�ϣ������ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ���������·�ش�

��֪��CH3CHO + O2��CH3COOH
��1���������������������仯����__________������ţ���
�ٷ��� ���ѽ�
��2��A��������__________��
��3����ӦII�Ļ�ѧ����ʽ��________________��
��4��DΪ�߷��ӻ������������������ְ�װ���ϣ���ṹ��ʽ��________________��
��5��E������ζ�����ʣ���ӦIV�Ļ�ѧ����ʽ��______________________��
��6�����й���CH2��CH��COOH��˵����ȷ����__________��
����CH3CH��CHCOOH��Ϊͬϵ��
�ڿ�����NaHCO3��Һ��Ӧ�ų�CO2����
����һ�������¿��Է���ȡ�����ӳɡ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ݸ�Ŀ���еġ�ʯ���Ŀ��д����������ޤ֮����ɹ���ջң���ˮ��֭������������ʯ����·��棬��ȥ�����档������˵����������
A. ��ʯ��к������Ӽ� B. ��ʯ��к��м��Թ��ۼ�
C. ��ʯ������ӻ����� D. ��ʯ��к��зǼ��Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
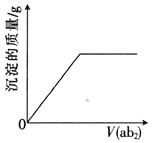
����Ŀ��������ͨ��70�����������ˮ��Һ��,��ͬʱ������������������ԭ��Ӧ��δ��ƽ����NaOH+Cl2��NaCl+NaClO+H2O����Ӧ��ɺ�����Һ��NaClO��NaClO3����Ŀ֮��Ϊ5��2�������Һ��NaCl��NaClO����Ŀ֮��Ϊ( )
A.3��1B.2��1C.15��2D.1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.ij�¶�ʱ�����ݻ�Ϊ2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ����ش�
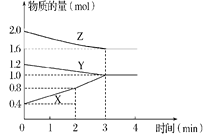
��1���÷�Ӧ�Ļ�ѧ����ʽΪ_________����X��Y��Z��ʾ����
��2���ӷ�Ӧ��ʼ��2 minĩ��X��ƽ����Ӧ����Ϊ___________________��
��3���÷�Ӧ��________(����ĸ���)��ʼ�ġ�
A ����Ӧ B �淴Ӧ C �����淴Ӧͬʱ
��4�������������䣬ֻ����Y�����������÷�Ӧ�����ʲ������仯����YΪ___________̬��
��. �������ƺ͵������������Һ�з�Ӧ�Ļ�ѧ����ʽΪ 5Na2SO3+2KIO3+H2SO4 = 5Na2SO4+K2SO4+I2+H2O���÷�Ӧ�Ļ����ϸ��ӣ�һ����Ϊ�����¼�����
��IO3�� + SO32���� IO2�� + SO42���������� ��IO2�� + SO32���� IO�� + SO42�����죩��
��5I��+ 6H+ + IO3�� ��3I2 +3H2O���죩�� ��I2 + SO32�� + H2O ��2I�� +SO42�� + 2H+���죩��
��1���ݴ��Ʋ⣬�÷�Ӧ���ܷ�Ӧ������__________����Ӧ������
��2����Ԥ����������Һ�м��������Һ����_________����(���Ӧ���ӷ���)��Ӧ��ʱ��Һ�Ż������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com