
| A. | 该有机物分子中不含有氧原子 | B. | 该有机物分子中含一个氧原子 | ||
| C. | 该有机物一个分子中含2个氧原子 | D. | 该物质结构简式为CH3CHO |
分析 生成二氧化碳和水各4mol,含O原子为12mol,共消耗5mol氧气,由氧原子守恒可知有机物含氧原子,根据原子守恒确定有机物分子式,进而确定可能的结构简式.
解答 解:某种有机物2mol在氧气中充分燃烧,生成二氧化碳和水各4mol,
生成物中O原子的物质的量为n(O)=n(H2O)+2n(CO2)=4mol+4mol×2=12mol,
有机物2mol在氧气中充分燃烧,共消耗5mol氧气,n(O)=5mol×2=10mol,
所以2mol该有机物中n(O)=12mol-10mol=2mol,
则有机物分子中C原子数目为$\frac{4mol}{2mol}$=2、H原子数目为$\frac{4mol×2}{2}$=4、O原子数目为$\frac{2mol}{2mol}$=1,
故有机物分子式为C2H4O,
有机物的结构简式为CH3CHO或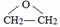 ,
,
故选B.
点评 本题考查有机物分子式确定,掌握燃烧法利用原子守恒确定有机物的分子式,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题

| A. | 用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集H2气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图④中的原电池装置反应不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2S3、I2 | B. | FeS、S、Al(OH)3 | C. | Al(OH)3、I2 | D. | Fe(OH)3、Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com