
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式).分析 由信息中A为芳香烃,分子式为C8H8,则A为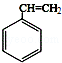 ,结合图中转化关系可知,A与水发生加成反应得B为
,结合图中转化关系可知,A与水发生加成反应得B为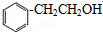 ,B发生氧化反应得C为
,B发生氧化反应得C为 ,C发生成信息中的加成反应得D为
,C发生成信息中的加成反应得D为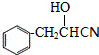 ,D水解得E为
,D水解得E为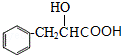 ,E在浓硫酸作用下发生消去反应得F为
,E在浓硫酸作用下发生消去反应得F为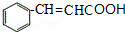 ,F与乙醇发生酯化反应得肉酸乙酯为
,F与乙醇发生酯化反应得肉酸乙酯为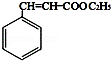 ,以此来解答.
,以此来解答.
解答 解:(1)A为 ,A所含的官能团名称为碳碳双键,肉酸乙酯的结构简式为
,A所含的官能团名称为碳碳双键,肉酸乙酯的结构简式为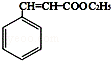 ,
,
故答案为:碳碳双键;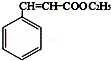 ;
;
(2)根据上面的分析可知,在反应①-⑥中属于加成反应的是①③,
故答案为:①③;
(3)反应②的化学方程式为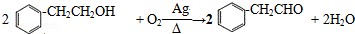 ,
,
故答案为: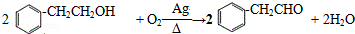 ;
;
(4)反应E→F的过程中,存在副产物,G是副产物之一,分子中存在三个六元环的结构简式为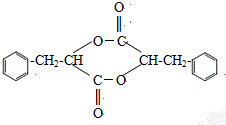 ,H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应,
,H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应,
故答案为: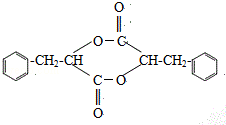 ;缩聚反应;
;缩聚反应;
(5)C的同分异构体,符合以下条件①遇FeCl3溶液发生显色反应,说明有酚羟基,②有两个侧链的芳香族化合物,符合条件的C的同分异构体为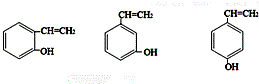 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中碳链变化、官能团变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意信息的应用,题目难度不大.


科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
臭氧在烟气脱硝中的反应为2NO2(g)+O2(g) N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图象如下列选项,其中对应分析结论正确的是( )

查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列有关物质的分类正确的是
①同素异形体:红磷、P4
②混合物:石英、水玻璃、淀粉、水银、王水、漂白粉
③化合物:HCl、MgCl2、HD
④酸性氧化物:CO2、SO2、Mn2O7
⑤盐:醋酸钠、氯化铵、纯碱、硫氢化钾
⑥弱电解质:CH3COOH、H2O、NH3、BaSO4、HF
⑦高分子化合物:糖类、蛋白质、酚醛树脂
⑧同分异构体:二乙酸乙二酯、乙二酸二乙酯
A.①③⑦B.①④⑤C.②⑥⑧D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A. ②③④⑤ B. ①②③④⑤ C. ②③①④⑤ D. ②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||


查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 左室中NaOH的浓度不变 | |
| B. | 工作时,OH-向左迁移 | |
| C. | 右室电极反应为C2H5OH+5OH--4e-=CH3COO-+4H2O | |
| D. | 右室生成CH3COONa1.5mol,理论上左室生成氢气67.2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com