
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,降低反应的活化能,可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 金属腐蚀就是金属失去电子被氧化的过程 | |
| D. | 电解法精炼铜时,以粗铜作阳极,粗铜中的所有金属都以离子的形式进入电解质溶液 |
分析 A.活化分子有合适取向时的碰撞才是有效碰撞;
B.升高温度,活化能不变;
C.金属失去电子而被氧化,为腐蚀的原理;
D.粗铜中含有金、银等金属.
解答 解:A.活化分子有合适取向时的碰撞才是有效碰撞,活化分子之间发生的碰撞不一定为有效碰撞,故A错误;
B.加入催化剂可降低活化能,但升高温度,活化能不变,故B错误;
C.金属单质只具有还原性,失去电子而被氧化,为腐蚀的原理,故C正确;
D.粗铜中含有金、银等金属,在电解时沉积在阳极,不参与电极反应,故D错误.
故选C.
点评 本题考查反应速率的影响因素以及金属的腐蚀、电解等,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:实验题
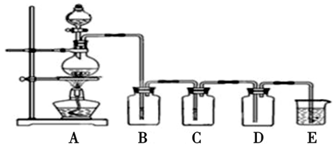
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-lKNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+,Na+、SO42- | |
| C. | 0.1 mol•L-1 FeCl3溶液:K+、NH4+、Cl-、S2- | |
| D. | 在无色透明溶液中:Ba2+、Ca2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 | 离子方程式 |
 | ①溶液分层 ②下层呈橙色. | Cl2+2Br-═Br2+2Cl- |
 | ①溶液分层 ②下层呈紫色 | Br2+2I-=I2+2Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
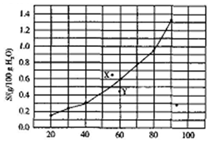
| A. | 溴酸银的溶解是一个熵增、焓减过程 | |
| B. | 对应温度下,X点的分散系中,V(溶解)>v(沉淀) | |
| C. | Y点的分散系中,c(Ag+)•c(BrO3-)>6.25×10-4 | |
| D. | 60℃时溴酸银饱和溶液中c(BrO3-)=0.025mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com