
| A. | 一定条件下反应N2+3H2$?_{加热}^{催化剂}$2NH3,达到平衡时,3v正(H2)=2v正(NH3) | |
| B. | 10mL浓度为1mol/L的盐酸与过量的Zn粉反应,若加入适量的CH3COONa溶液,既能降低反应速率,又不影响H2的生成 | |
| C. | 将pH=a+1的氨水稀释为pH=a的过程中,c(OH-)/c(NH3•H2O)变小 | |
| D. | 常温下,向浓度为0.1mol/L的CH3COONa溶液中加入等体积等浓度的CH3COOH,混合溶液的pH=7 |
分析 A.达到平衡时,不同物质表示的正逆反应速率之比等于计量数比;
B.CH3COONa与HCl反应生成醋酸,溶液中氢离子浓度减小;
C.加水稀释促进电离,溶液中OH-的物质的量增大,NH3•H2O的物质的量减小;
D.等浓度的CH3COONa和CH3COOH混合溶液显酸性.
解答 解:A.达到平衡时,不同物质表示的正逆反应速率之比等于计量数比,当2v正(H2)=3v正(NH3)时,不一定达到平衡状态,故A错误;
B.CH3COONa与HCl反应生成醋酸,溶液中氢离子浓度减小,但是酸能电离出来的氢离子的总物质的量不变,所以既能降低反应速率,又不影响H2的生成,故B正确;
C.加水稀释促进电离,溶液中OH-的物质的量增大,NH3•H2O的物质的量减小,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{\frac{n(O{H}^{-})}{V}}{\frac{n(N{H}_{3}•{H}_{2}O)}{V}}$变大,故C错误;
D.等浓度的CH3COONa和CH3COOH混合溶液,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液显酸性,即pH<7,故D错误.
故选B.
点评 本题考查了化学平衡状态的判断、影响反应速率的因素、弱电解质的电离、盐的水解等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,注意把握弱电解质稀释时溶液中离子浓度的变化,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,不可制得Fe(OH)3胶体 | |
| B. | 胶体与其他分散系的本质区别是胶体能发生丁达尔效应 | |
| C. | 用半透膜分离淀粉和食盐的混合液 | |
| D. | Fe(OH)3胶体逐渐加入稀硫酸,会产生沉淀而后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的结构式H-C≡C-H
,A的结构式H-C≡C-H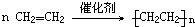 反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;
反应类型加聚反应;F生成B化学方程式HCl+CH2=CH2→CH3CH2Cl;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com