
| A. | 加水稀释,电离平衡正向移动,溶液中n(H+)减小 | |
| B. | 加热,电离平衡正向移动,溶液中c(CH3COO-)增大 | |
| C. | 通入少量HCl气体,电离平衡逆向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡逆向移动,溶液中c(H+)减小 |
分析 醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,向醋酸溶液中加入含有氢离子或醋酸根离子的物质抑制醋酸电离,加入和氢离子或醋酸根离子反应的物质促进醋酸电离,以此解答该题.
解答 解:A.加水稀释,电离平衡正向移动,溶液中n(H+)增大,故A错误;
B.弱电解质的电离为吸热过程,加热促进电离,溶液中c(CH3COO-)增大,故B正确;
C.氯化氢是强电解质,在水溶液里完全电离,则向醋酸中加入等浓度的盐酸,溶液中氢离子浓度增大,抑制醋酸电离,故C错误;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,则电离平衡逆向移动,溶液中c(H+)减小,故D正确.
故选AC.
点评 本题考查了弱电解质的电离,明确加水稀释时促进弱电解质电离,但酸溶液中除了氢氧根离子外,其它离子浓度都减小,再结合平衡移动影响因素来分析解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
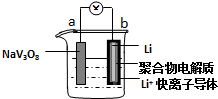
| A. | 放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8 | |
| B. | 充电过程中Li+从阳极向阴极迁移 | |
| C. | 充电过程中阳极的电极反应式为NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 该电池可以用硫酸钠溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
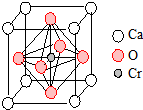 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.
翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
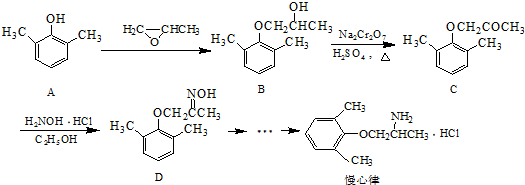
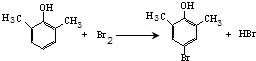 .
. .
. .
. .
.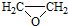 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (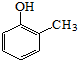 )和乙醇为原料制备
)和乙醇为原料制备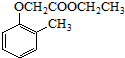 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ④⑥ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
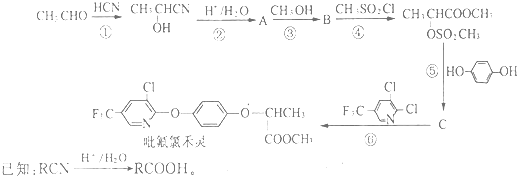
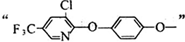
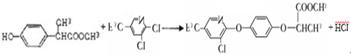 ;
;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com