

| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |
分析 (1)根据SO2与石灰和氧气反应生成硫酸钙和水书写;
(2)①根据平衡常数为生成物浓度的幂次方之积比上反应物浓度的幂次方之积书写;
②a.根据图表数据可知,温度越高,SO2的转化率越小,说明升温平衡向逆向移动判断;
b.反应达到平衡时,正逆反应速率一定相等,浓度不一定相等;
c.根据反应速率之比等于系数之比,结合反应达到平衡时,正逆反应速率一定相等判断;
d.升高温度,平衡向吸热方向移动,使用催化剂平衡不移动;
③a.根据(NH4)2SO3溶液物料守恒判断;
b.根据(NH4)2SO3溶液电荷守恒判断;
c.根据(NH4)2SO3溶液显弱碱性及其水解为微弱的判断;
(3)①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
根据盖斯定律①×$\frac{1}{2}$+②-③×$\frac{1}{2}$计算;
(4)①电解池阳极发生氧化反应,阴极发生还原反应,根据与Y极相连的电极产生的氧气判断;
②电解池阴极发生还原反应,根据反应物结合化合价的变化分析.
解答 解:(1)SO2与石灰和氧气反应生成硫酸钙和水,方程式为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O,故答案为:2SO2+2Ca(OH)2+O2=2CaSO4+2H2O;
(2)①在一定条件下,二氧化硫和氧气发生反应生成三氧化硫,方程式为:2SO2+O2$?_{△}^{催化剂}$2SO3,平衡常数表达式K=$\frac{c(SO{\;}_{3}){\;}^{2}}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$,故答案为:K=$\frac{c(SO{\;}_{3}){\;}^{2}}{c(SO{\;}_{2}){\;}^{2}c(O{\;}_{2})}$;
②a.根据图表数据可知,温度越高,SO2的转化率越小,说明升温平衡向吸热的逆向移动,所以该反应正反应为放热反应即△H<0,故a正确;
b.反应达到平衡时,SO2,O2,SO3 的浓度不一定都相等,故b错误;
c.反应速率之比等于系数之比,所以v(SO2)逆=2v(O2)逆,又反应达到平衡状态时v(SO2)正=v(SO2)逆,所以反应达到平衡状态时,v(SO2)正=2v(O2)逆,故c正确;
d.升高温度,平衡向吸热方向即逆向移动,SO2的转化率减小,使用催化剂平衡不移动,故d错误;
故选:ac;
③a.(NH4)2SO3溶液物料守恒,则c(NH4+)+c(NH3•H2O)=2[c(SO32-)+c(HSO3-)+c(H2SO3)],故a正确;
b.(NH4)2SO3溶液电荷守恒,则c(NH4+)+c (H+)=2c (SO32-)+c (HSO3-)+c (OH-),故b错误;
c.因为(NH4)2SO3溶液显弱碱性,则c (OH-)>c (H+),又水解微弱的,所以c(NH4+)>c (SO32-)>c (OH-)>c (H+),故c正确;
故选:ac;
(3)①2CO(g)+O2(g)═2CO2(g)△H=-283kJ•mol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
③2CH3OH(l)+3O2(g)═2CO2(g)+4H2O (l)△H=-725.8kJ•mol-1
根据盖斯定律①×$\frac{1}{2}$+②-③×$\frac{1}{2}$得,CO(g)+2H2(g)=CH3OH(l)△H=-283×$\frac{1}{2}$-571.6+725.8×$\frac{1}{2}$=-350.2kJ•mol-1;
故答案为:CO(g)+2H2(g)=CH3OH(l)△H=-350.2kJ•mol-1;
(4)①根据图示知:与Y相连的电极产生O2,电解H2O-CO2混合气体,氧离子失去电子生成氧气,发生氧化反应,电解池阳极发生氧化反应,所以Y是电源的正极,故答案为:正极;
②电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故答案为:H2O+2e-═H2↑+O2-.
点评 本题考查较综合,涉及方程式的书写、盖斯定律、化学平衡移动的影响因素以及电解池原理等知识点,外界条件对化学平衡的影响是考查热点,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
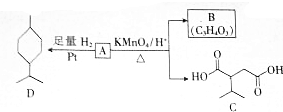
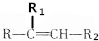 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$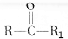 +R2COOH
+R2COOH .A与等物质的量的溴单质反应的产物有3种.
.A与等物质的量的溴单质反应的产物有3种. +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
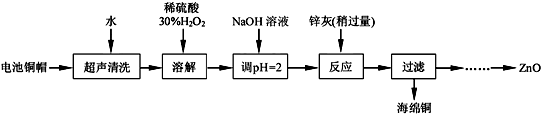
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 完全沉淀的pH | 3.2 | 8.8 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com