
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
分析 A、极值分析若为氧气分子数为$\frac{6.4g}{32g/mol}$×NA=0.2NA,若全部为臭氧分子数=$\frac{6.4g}{48g/mol}$×NA=0.13NA,混合物含分子数在二者之间;
B、标准状况四氯化碳不是气体;
C、溶液体积不知不能计算微粒数;
D、n=$\frac{m}{M}$计算得到物质的量,结合铁和水蒸气反应生成四氧化三铁和氢气,计算电子转移数;
解答 解:A、极值分析若为氧气分子数为$\frac{6.4g}{32g/mol}$×NA=0.2NA,若全部为臭氧分子数=$\frac{6.4g}{48g/mol}$×NA=0.13NA,混合物含分子数在二者之间,不是0.4NA,故A错误;
B、标准状况四氯化碳不是气体,2.24 L CCl4分子物质的量不是0.1mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、n=$\frac{m}{M}$计算得到物质的量=$\frac{16.8g}{56g/mol}$=0.3mol,结合铁和水蒸气反应生成四氧化三铁和氢气计算电子转移数,3Fe~Fe3O4~8e-,则Fe与足量水蒸气完全反应失去0.8NA个电子,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积应用条件分析,氧化还原反应电子转移计算,注意物质的量和微粒数的计算应用,掌握基础是关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
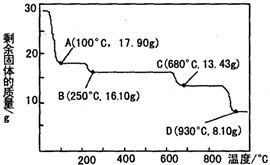 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油和矿物油都属于酯类物质 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| D. | 蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 蒸发皿、玻璃棒、酒精灯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 | 试管、胶头滴管 |
| C | 用8.0mol.L-1的盐酸配制 250mL1.5mol.L-1的盐酸 | 250m容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、锥形瓶、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
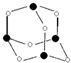 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.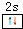 ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.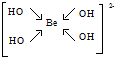 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com