
【题目】火力发电厂释放出的大量NONOx、SO2、CO2会对环境造成污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现节能减排、废物利用等目的.
(1)脱硝:利用甲烷催化还原NOx; CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
甲烷直接将NO2还原为N2的热化学方程式为 .
(2)脱硫:①某种脱硫工艺将废气处理后可获得硫酸铵和硝酸铵,物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,前者的c(NH4+)与后者的c(NH4+)的关系是 . A.大于2倍 B.等于2倍 C.介于2倍与2倍之间 D.小于1倍
②25℃时pH均为4的硝酸铵溶液和稀硝酸中由水电离出的氢离子浓度分别为c1、c2 , 则c1与c2的比值等于 .
(3)脱碳:废气中的CO2转化为甲醇(CH3OH)可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2molL﹣1H2SO4溶液.电极c上发生的电极反应式为 , 当电池中有1mole﹣发生转移时左右两侧溶液的质量之差为g (假设反应物a、b耗尽,忽略气体的溶解). 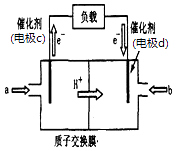
【答案】
(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ/mol
(2)A;106
(3)CH3OH+H2O﹣6e﹣=CO2↑+6H+;
【解析】解:(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJmol﹣1,
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1,
不管化学反应是一步完成还是分几步完成,其反应热是相同的.利用盖斯定律将两式相加,可得
2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=﹣1734 kJ/mol,
即CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJmol﹣1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867 kJ/mol;(2)①物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,铵根离子水解溶液显酸性,铵根离子浓度越大其水解程度越小,前者的c(NH4+)与后者的c(NH4+)的关系是大于其2倍,故选A,
故答案为:A;②硝酸铵水解促进水的电离,C1=10﹣4 mol/L,稀醋酸抑制水的电离,C2=c(OH﹣)= ![]() =10﹣10 mol/L,因此则c1与c2的比值等于
=10﹣10 mol/L,因此则c1与c2的比值等于 ![]() =106,
=106,
故答案为:106 ;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻 ![]() ×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g×
×12g=2g,还要有1molH+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e﹣=2H2O,右侧质量增加32g× ![]() =8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,
故答案为:CH3OH+H2O﹣6e﹣=CO2↑+6H+;12.
(1)根据盖斯定律,利用已知化学反应方程式乘以某个系数相加或相减,构造出目标化学反应方程式,该化学反应的焓变即为已知化学反应方程式的焓变乘以某个系数相加或相减得到;(2)①物质的量浓度相等的硫酸铵溶液和硝酸铵溶液,铵根离子水解溶液显酸性,铵根离子浓度越大其水解程度越小;②硝酸铵水解促进水的电离,C1=10﹣4 mol/L,稀醋酸抑制水的电离,C2=c(OH﹣)= ![]() =10﹣10 mol/L;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,正极反应式为O2+4H++4e﹣=2H2O,按照电极反应式计算;
=10﹣10 mol/L;(3)负极反应式为CH3OH﹣6e﹣+H2O=CO2+6H+,正极反应式为O2+4H++4e﹣=2H2O,按照电极反应式计算;


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学在研究前18号元素时发现,可以将它们排成如下图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是
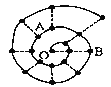
A. 离O点越远的元素原子半径越大 B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素 D. A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:
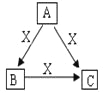
(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 .
(1)A分子的质谱图如图所示,从图中可知其相对分子质量是90,则A的分子式是 . 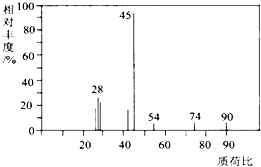
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是 .
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 .
(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是L.
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是从元素周期表中截取的一部分,已知X、Y、Z、W为四种短周期主族元素,下列说法正确的是
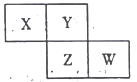
A. 四种元素的原子有可能均能与氢原子形成18电子分子
B. Z元素可能为金属
C. Z的原子半径不一定比Y的原子半径大
D. W的原子序数不可能是X的原子序数的3倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气脱硫能有效减少二氧化硫的排放。目前最常用的脱硫技术是湿法石灰石—石膏脱硫,即利用石灰石和烟气中的SO2反应生成石膏一脱除SO2。某研究性学习小组在实验室利用如图所示装置制备模拟烟气(主要成分为SO2、CO2、N2、O2),并测定烟气中SO2的体积分数以及研究烟气通过转化器的脱硫效率。回答下列问题:

Ⅰ.模拟烟气的制备。
(1)装置 A中盛装浓硫酸的仪器名称是_____________,写出装置A中发生反应的化学方程式:________。
Ⅱ.测定烟气中SO2的体积分数。
(2)已知装置C、D中盛有的药品分别是酸性KMnO4溶液、饱和NaHCO3溶液,写出装置C的作
用:_______________,装置D中饱和NaHCO3溶液中的离子浓度由大到小的关系为_____________。
(3)①甲同学认为应该在装置C、D之间增加一个盛有品红溶液的洗气瓶,理由是_____________。
②乙同学根据模拟烟气的流速a mL/min和t1分钟后测得的量筒内液体的体积VmL,计算烟气中二氧化硫的体积分数。为保证准确读取量筒读数应注意:a.将装置冷却至室温;b._________;c.平视。
Ⅲ.模拟烟气通过转化器的脱硫效率研究。
(4)将模拟烟气通过装置E,其中盛有FeCl2、FeCl3的混合溶液,它可以催化SO2与氧气的反应以达到脱硫的目的。写出催化剂参与反应过程中的离子方程式:SO2+2H2O+2Fe3+=SO42-+2Fe2++4H+、____________。
(5)若模拟烟气仍以amL/min的流速通过转化器E装置,t2分钟后,向E装置中加入酸化的BaCl2溶液,得到白色浑浊液,经过滤、洗涤、干燥、称量,得到m g固体。若实验测得的气体体积已折算为标准状况下的体积,则该转化器的脱硫效率是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,标准状况下某O2和N2的混合气体mg含有b个分子,则ng该混合气体在相同状况下所占的体积应是( )
A.![]() L
L
B.![]()
C.![]()
D.![]() L
L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g 含有少量中性易溶杂质的样品,配成500mL 待测溶液。用0.1000mol·L-1的硫酸滴定,写出该中和反应的热化学方程式________________________________(中和热ΔH=-57.3 kJ/mol)。
(2)滴定过程中,眼睛应注视___________,若用酚酞作指示剂达到滴定终点的标志是_____________。
(3)根据下表数据,计算烧碱样品的纯度是___________(用百分数表示,保留小数点后两位)
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL)) | ||
第一次 | 10. 00 | 0. 40 | 20. 50 |
第二次 | 10. 00 | 4. 10 | 24. 00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果____________。
②若将锥形瓶用待测液润洗,然后再加入10. 00mL待测液,则滴定结果____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( ) 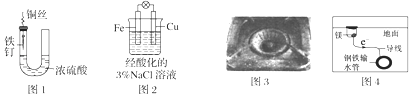
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com