
现要配制0.01 mol/L的KMnO4溶液,下列操作导致所配溶液浓度偏高的是
A.称量时,使用了游码,但砝码和药品放颠倒了
B.定容时俯视容量瓶刻度线
C.原容量瓶洗净后没有干燥
D.摇匀后见液面下降,再加水至刻度线
科目:高中化学 来源:2015-2016学年江苏省高一上期中化学卷(解析版) 题型:填空题
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 ;
(2)漂白粉受空气中的CO2作用,即产生次氯酸,化学反应方程式为 ;
(3)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明漂白粉溶液呈 性,并具有 性。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上第一次阶段测化学试卷(解析版) 题型:选择题
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1 = ―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H 2= ―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H 3= ―Q3 kJ/mol
(已知:H2S完全燃烧生成SO2,不完全燃烧生成S)判断△H1、△H2、△H3三者关系正确的是
A. △H1>△H2>△H3 B. △H1>△H3>△H2
C. △H3>△H2>△H1 D. △H2>△H1>△H3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列物质中,不属于电解质的是
A.Cu B.NaCl C.NaOH D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期期中测试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.硝酸银与盐酸反应: AgNO3+Cl-===AgCl↓+NO
B.铜片插入硝酸银溶液中:Cu+Ag+===Ag+Cu2+
C.硫酸和氯化钡溶液反应:Ba2++SO42-===BaSO4↓
D.铁钉放入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:实验题
实验室欲配制480 mL 0.1 mol•L-1 Na2CO3溶液,请据此回答下列问题:
(1)实验时,应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)在配制Na2CO3溶液时需用的玻璃仪器主要有量筒、烧杯、玻璃棒、 、 。
(3)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 。(填字母)
A.容量瓶内壁附有水珠而未干燥处理
B.忘记将洗涤液加入容量瓶
C.定容时俯视刻度线
D.摇匀后发现液面低于刻度线,加水至凹液面恰好与刻度线相切
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
下列有关于Cl2的说法中,不正确的是
A.Cl2是一种黄绿色、密度比空气大的有毒气体
B.红热的铁丝在Cl2中剧烈燃烧FeCl3
C.当有大量氯气逸到空气中时,可用浸有NaOH溶液的毛巾捂住鼻子
D.Cl2的氧化性比Br2强,而Br-的还原性却比Cl-强
查看答案和解析>>
科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:实验题
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
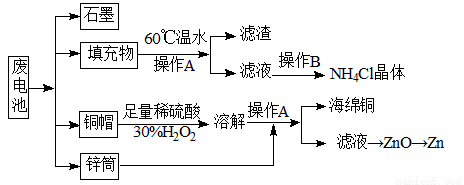
(1)操作A的名称为 。
(2)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用___________方法除去溶液中过量的H2O2。
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
① 当1 mol MnO2参加反应时,共有 mol电子发生转移。
② MnO (OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(5)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
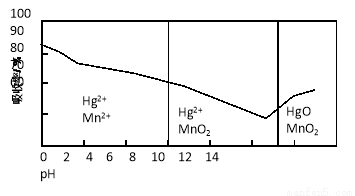
根据上图可知:
① pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
② 在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:填空题
I.化工工业中常用乙苯脱氢的方法制备苯乙烯。
已知某温度下:
反应①:CO2 (g) +H2 (g)→CO(g) + H2O(g),ΔH = +41.2 kJ/mol;
反应②: 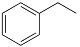 (g)→
(g)→ (g)+H2(g),ΔH= +117.6 kJ/mol;
(g)+H2(g),ΔH= +117.6 kJ/mol;
①②的化学反应平衡常数分别为K1、K2,
(1)请写出二氧化碳氧化乙苯制备苯乙烯的热化学反应方程式 ,该反应的化学平衡常数K= (用K1、K2表示)
(2)对于反应①,恒温恒容条件下,向密闭容器中加入2molCO2 和2molH2,当反应达到平衡后,以下说法正确的是
A.因为该反应是吸热反应,所以升高温度,正反应速率增大,逆反应速率减小;
B.若再加入1molCO2、1mol H2,平衡不移动;
C.若再加入CO2则平衡向正反应方向移动,CO的体积分数减小;
D.若充入He,平衡不移动,反应物和产物的浓度都不变;
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2;请在下图中画出t1之后的正逆反应曲线,并作出标注。

II.一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
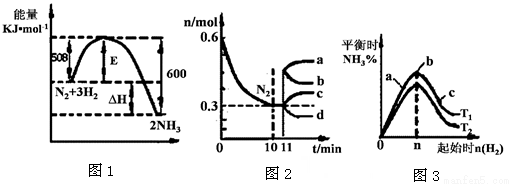
(4)升高温度,该反应的平衡常数 (填“增大”或“减小”或“不变”)。
(5)由图2信息,计算10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
(6)图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com