
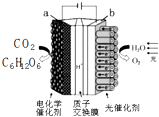
 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
分析 A.该装置将光能和电能转化为化学能;
B.与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动;
C.电池总的方程式为:6CO2+6H2O$\frac{\underline{\;电解\;}}{\;}$C6H12O6+6O2,即生成6mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D.a与电源负极相连,所以a是阴极,电极反应式为:6CO2+24H++24e-=C6H12O6+6 H2O.
解答 解:A.该装置将光能和电能转化为化学能,是新型化学电源装置,故A正确;
B.a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故B错误;
C.电池总的方程式为:6CO2+6H2O$\frac{\underline{\;电解\;}}{\;}$C6H12O6+6O2,即生成6mol的氧气,阴极有6mol的二氧化碳被还原,也就是生成1mol的氧气,阴极有1mol的二氧化碳被还原,所以被还原的二氧化碳为44g,故C正确;
D.a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:6CO2+24H++24e-=C6H12O6+6 H2O,故D错误;
故选AC.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向,难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
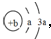 ,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题:
,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题: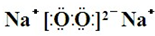 ,所含有的化学键类型为离子键和共价键.
,所含有的化学键类型为离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ NO3- I-SO42- | B. | MnO4- K+NO3-Na+ | ||
| C. | K+Al3+Cl-SO42- | D. | Mg2+SO32-Br-Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的沸点:Z>M | |
| C. | X、Z与M不可能存在同一离子化合物中 | |
| D. | Y2Z的溶液:c(Y+):c(Z2-)>2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、Na2SiO3 | B. | Na2CO3、SiO2 | C. | Na2SiO3 | D. | SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com