
| A、0.1 mol H2O和D2O组成的混合物中含有的中子数是NA |
| B、常温常压下,NO2和N2O4的混合物46g中约含有2NA个氧原子 |
| C、1 mol CH3+(碳正离子)中含有电子数为10NA |
| D、在Cu-Zn原电池中,正极产生1.12LH2时,负极产生了0.05 NA 个 Zn2+ |
| 46g |
| 46g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2+Br2+2H2O═H2SO4+2HBr与2HBr+H2SO4(浓)═Br2+SO2↑+2H2O互为可逆反应 |
| B、既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 |
| C、在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 |
| D、电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8种 | B、11种 |
| C、14种 | D、15种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
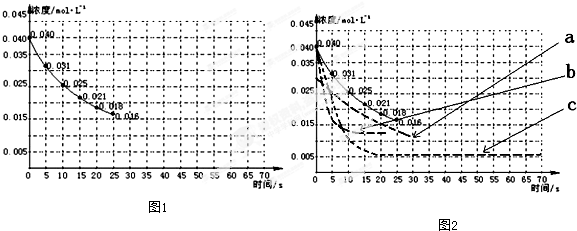
| 实验编号 | CO2起始浓度/mol?L-1 | 反应温度/℃ | 反应压强/kPa | 是否加入催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |

| 弱酸化学式 | HC1O | H2CO3 |
| 电离平衡常数 | 4.7×l0-8 | Ka1= |
| c(Cd2+) |
| c(ca2+) |
| KsP(CdCO3) |
| Ksp(CaCO3) |
| c(Cd2+) |
| c(Ca2+) |
| Ksp(CdCO3) |
| Ksp(CaCO3) |
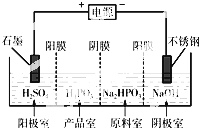
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.045 mol |
| B、0.03 mol |
| C、0.0225 mol |
| D、0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式为CH2CH2 |
B、羟基的电子式: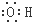 |
C、Ca2+的结构示意图为 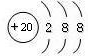 |
| D、乙醇的分子式:CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com