氮、碳及其化合物有广泛的用途.请回答下列问题:
(1)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol
N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ/mol
2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ/mol
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
.
(2)将1.0mol CH
4和2.0mol H
2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH
4(g)+H
2O(g)?CO(g)+3H
2(g).CH
4的转化率与温度、压强的关系如图1
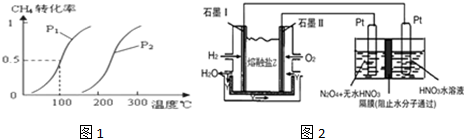
①已知100℃时达到平衡所需的时间为5min,则用H
2表示的平均反应速率为
.
②图中的P
1
P
2(填“<”、“>”或“=”),100℃时平衡常数为
.
③该反应的△H
0(填“<”、“>”或“=”).
(3)氨气溶于水得到氨水.在25℃下,将a mol?L
-1的氨水与b mol?L
-1的盐酸等体积混合,反应后溶液显中性,则c(NH
+4)
(填“>”、“<”或“=”)c(Cl
-);用含a和b的代数式表示出氨水的电离平衡常数表达式
.
(4)N
2O
5是一种新型硝化剂,其性质和制备受到人们的关注.现以H
2、O
2、熔融盐Na
2CO
3组成的燃料电池,采用电解法制备N
2O
5,装置如图2示,其中Y为CO
2.写出石墨I电极上发生反应的电极反应式
.在电解池中生成N
2O
5的电极反应式为
.




 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.