考点:离子方程式的书写
专题:离子反应专题
分析:A、溶液呈中性,说明氢离子和氢氧根离子的物质量相等,设都为1mol,1molOH-同时电离出0.5moBa2+而产生lmolH+同时产生1molSO42-,硫酸根离子过量;
B、两者发生氧化还原反应;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子.
解答:
解:A、溶液呈中性,说明氢离子和氢氧根离子的物质量相等,设都为1mol,1molOH-同时电离出0.5moBa2+而产生lmolH+同时产生1molSO42-,硫酸根离子过量,正确的离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B、两者发生氧化还原反应,当NaClO少量时的离子方程式为6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-,故B错误;
C、亚硫酸氢根离子也参加了反应,而且两者的量之比为1:1,离子方程式为NH4++HSO3-+2OH-═NH3?H2O+H2O+SO32-,故C错误;
D、设体积为10L,则2mol的NH4Al(SO4)2溶液电离出铵根离子和铝离子,首先作用的是铝离子,而2mol的铝离子刚好需6mol的氢氧根离子,正确的离子方程式为 2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,故D正确;
故选D.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案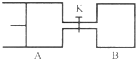 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
 在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答:
在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g,试回答: 金属镍及其化合物在能源、材料等工业中都有重要用途.
金属镍及其化合物在能源、材料等工业中都有重要用途.