
| T/K | 303 | 313 | 323 |
| n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
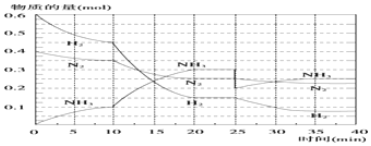
分析 (1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,结合反应方程式中各物质的聚集状态解答;
(2)①反应速率v=$\frac{\frac{△n}{V}}{△t}$计算;
②根据图象知,平衡向正反应方向移动,10min时是连续的,三种气体物质的速率增加倍数相同,说明为增大压强、使用催化剂;
③25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;平衡常数只受温度的影响,据此判断;
解答 解:(1)由表中数据可知,升高温度,NH3生成量增大,说明平衡向正反应方向移动,则正反应应为吸热反应,a>0,由方程式可知反应生成气体的物质的量增多,则△S>0,
故答案为:>;>;
(2)①根据反应速率v(NH3)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{(0.1-0)mol}{2L}}{10min}$=0.005mol/(L.min),
故答案为:0.005mol/(L.min);
②由图象可知各组分物质的量变化增加,且10min时变化是连续的,20min达平衡时,△n(N2)=0.025mol×4=0.1mol,
△n(H2)=0.025mol×12=0.3mol,△n(NH3)=0.025mol×8=0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大,降低温度,应该反应速率减小,增加NH3物质的量,逆反应速率增加的倍数大,故使用催化剂、缩小体积符合,故选AB,
故答案为:AB;
③第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;由图象可以看出,当反应进行到时35-40min,各物质的量不变,说明反应达到第二次平衡状态,平衡常数只受温度影响,温度不变,平衡常数不变,所以抽去0.1mol氨,
故答案为:移走 0.1 molNH3;=.
点评 本题考查反应自发进行判断、反应速率、化学平衡的计算、平衡移动以及平衡状态的判断,注意对图象的分析,是高考中的常见题型,试题基础性强,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
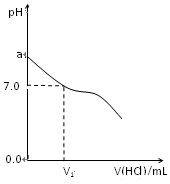 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有两个电子的原子一定在IIA 族 | |
| B. | IA族均为碱金属 | |
| C. | 同一周期核电荷数越大原子半径越大 | |
| D. | 同一主族核电荷数越大元素金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ③④ | C. | ②④⑥ | D. | ④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同 | |
| B. | 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键 | |
| C. | 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化 | |
| D. | 乙醇在铜催化作用下,能发生还原反应生成乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的性质很活泼,它与氢气混合后立即发生爆炸 | |
| B. | 可以用氢氧化钙溶液吸收实验室制取氯气时多余的氯气 | |
| C. | 检验Cl2中是否混有HCl方法是将气体通入硝酸银溶液 | |
| D. | 除去Cl2中的HCl气体,可将气体通入饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com