
 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.分析 提出猜想:浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所得气体中可能含有SO2和H2中的一种或两种,据此进行猜想;
(1)由题目信息可知,猜想三:所得气体中可能是SO2和H2的混合气体.二氧化硫具有还原性,可以使酸性高锰酸钾褪色,氢气不溶于水,不反应,试管中收集到氢气.
(2)氢气不纯,燃烧可能发生爆炸,故点燃前应先检验气体的纯度;
(3)铁与过量浓硫酸加热反应生成硫酸铁、二氧化硫气体和水,据此写出反应的化学方程式;
(4)能够与过氧化钠反应的有二氧化硫、水,过氧化钠与二氧化硫反应生成亚硫酸钠;水与过氧化钠反应生成氢氧化钠和氧气,二氧化硫与氢氧化钠反应生成亚硫酸钠,据此判断玻璃管中反应的生成物.
解答 解:提出猜想:浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所得气体中可能含有SO2和H2中的一种或两种,故生成的气体有三种情况:①所得气体中可能是SO2;②所得气体中可能是H2;③所得气体中可能是SO2和H2的混合气体,
故答案为:H2;SO2和H2.
(1)由题目信息可知,猜想三:所得气体中可能是SO2和H2的混合气体.二氧化硫具有还原性,可以使酸性高锰酸钾褪色,氢气不溶于水,不反应,试管中收集到氢气.
故答案为:甲中KMnO4溶液褪色;乙中KMnO4溶液颜色不变(或变浅但不完全褪色);试管中收集到无色气体;
(2)氢气不纯,燃烧可能发生爆炸,故点燃前应先检验气体的纯度,
故答案为:检验气体的纯度;
(3)加热条件下,铁与过量的浓硫酸反应生成硫酸铁、二氧化硫气体和水,反应的化学方程式为:2Fe+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O,
故答案为:2Fe+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+3SO2↑+6H2O;
(4)一定量的铁与浓硫酸加热时产生的气体中含有H2、SO2及水蒸气,当通过装有过量Na2O2粉末的玻璃管,可能发生反应:SO2+Na2O2=Na2SO4、2Na2O2+2H2O=4NaOH+O2↑、SO2+2NaOH=Na2SO3+H2O,所以玻璃管中反应的生成物可能含有:Na2SO4、Na2SO3、NaOH、O2,
故答案为:Na2SO4、Na2SO3、NaOH、O2(其他合理答案也得分).
点评 本题考查浓硫酸的性质,题目难度中等,掌握元素化合物的性质是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中需要全面把握基础知识.


科目:高中化学 来源: 题型:选择题
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ3 | D. | X3YZ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | 核外电子总数相同的原子,一定是同种元素的原子 | |
| D. | 化合反应和置换反应均属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
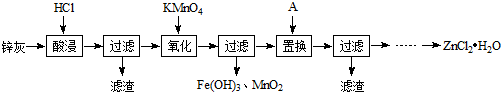
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
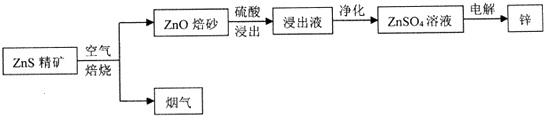
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
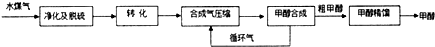
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 增大压强 | C. | 充入N2 | D. | 降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com