
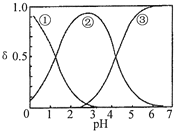
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A、曲线①代表的粒子是HC2O4- |
| B、0.1 mol?L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D、一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、K+、Cr2O72-、SO42-、NO3- |
| B、Na+、K+、SO42-、Cl- |
| C、Na+、Ca2+、HCO3-、Cl- |
| D、Na+、Ba2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O2中含有的阴离子数为0.2NA |
| B、标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA |
| C、常温常压下,8g O3含有4 NA个电子 |
| D、常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的氢化物溶液与其最高价氧化物对应的水化物溶液的酸碱性相反 |
| B、Y的氧化物既可与强酸反应又可与强碱反应,并可用来制作耐火材料 |
| C、X和Z的最高价氧化物对应的水化物的浓溶液都是具有强氧化性的酸 |
| D、Z的氢化物比X的氢化物更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ |
| C、①③④ | D、都正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com