
| A. | H2的燃烧热(△H)是285.8kJ•mol-1 | |
| B. | 反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)是571.6kJ•mol-1 | |
| C. | 反应2H2O(l)=2H2(g)+O2(g)只能在电解条件下进行 | |
| D. | 反应2H2O(l)=2H2(g)+O2(g)在一定条件下可以自发进行 |
分析 A、燃烧热(△H)是-285.8kJ•mol-1;
B、液态水变化为气体吸热;
C、反应不一定在电解条件下才能进行,也可在高温下进行;
D、根据△G=△H-T•△S<0自发判断.
解答 解:A、燃烧热(△H)是-285.8kJ•mol-1,故A错误;
B、2mol氢气与1mol氧气反应生成2mol液态水放出热量571.6kJ,液态水变化为气体吸热,2mol氢气与1mol氧气反应生成2mol气态水放出热量小于571.6kJ,所以反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)大于571.6kJ•mol-1,故B错误;
C、反应不一定在电解条件下才能进行,也可在高温下进行,故C错误;
D、△H>0,△S>0,则在一定温度下当△H<T•△S时,反应可自发进行,故D正确.
故选D.
点评 本题考查了热化学方程式的分析判断,化学反应能量变化和热化学方程式的表达意义是解题关键,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| E. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸反应放出SO2:Cu+4H++SO42-═Cu2++SO2↑+2H2O | |
| B. | 加热NH4Cl和氢氧化钠固体混合物:NH4++OH-═NH3↑+H2O | |
| C. | 稀硝酸与过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2 H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.
.若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
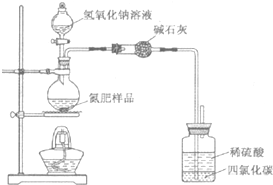 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | HCl溶液浓度(mol/L) | BOH溶液溶液(mol/L) | 混合后溶液pH |
| 甲 | 0.10 | 0.10 | 4.7 |
| 乙 | 0.10 | 0.30 | 7 |
| 丙 | 0.10 | 0.50 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
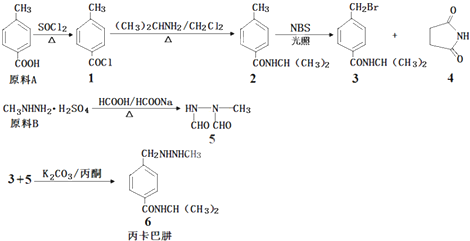
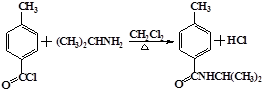 .
.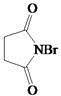 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
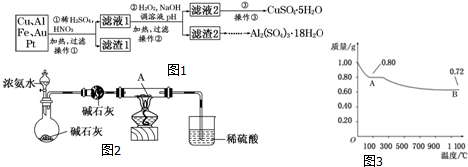
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com