
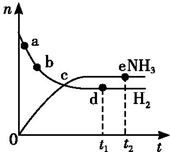
 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(H2)和n(NH3)随时间变化的关系如图所示.下列有关叙述一定正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相等 | |
| B. | c点和e点H2的转化率相等 | |
| C. | 平衡后再升高温度,不利于氨的合成 | |
| D. | d点时:n(H2):n(NH3)=3:2 |
分析 A.c点没有达到平衡,d、e点为平衡状态;
B.e点时氢气的转化率达到最大,c点向正反应方向移动;
C.合成氨为放热反应,升高温度平衡逆向移动;
D.d点达到平衡状态,H2、NH3的物质的量不再变化,图中开始及平衡时的物质的量未知.
解答 解:A.c点没有达到平衡,d、e点为平衡状态,则c点表示NH3生成速率大于NH3分解速率相等,故A错误;
B.e点时氢气的转化率达到最大,c点向正反应方向移动,则c点转化率小于e点H2的转化率,故B错误;
C.合成氨为放热反应,升高温度平衡逆向移动,则平衡后再升高温度,不利于氨的合成,故C正确;
D.d点达到平衡状态,H2、NH3的物质的量不再变化,图中开始及平衡时的物质的量未知,则不能计算d点时n(H2)、n(NH3)的比,故D错误;
故选C.
点评 本题考查物质的量随时间变化曲线,为高频考点,把握图象分析、平衡状态的判断为解答的关键,侧重分析与应用能力的考查,注意合成氨为放热反应,选项D为易错点,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:实验题
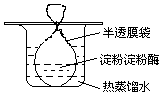 把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.
把一定量的淀粉和少量淀粉酶配成溶胶灌于半透膜袋中并置于盛有热的蒸馏水的烧杯中(如图所示).一段时间后进行如下实验,回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
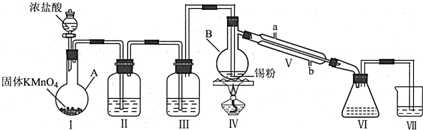
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在0-50min之间,pH=2和pH=7时R的降解百分率不相等 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度和溶液的pH均影响R的降解速率 | |
| D. | 在 20-25min之间,pH=10 时R的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
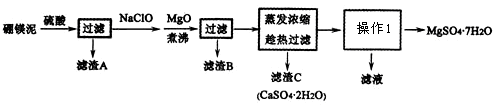
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
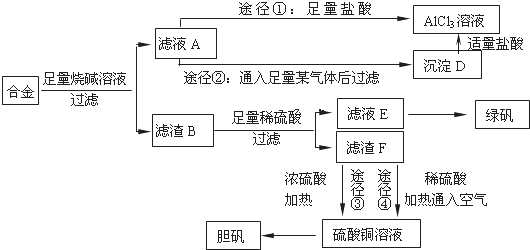
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com