
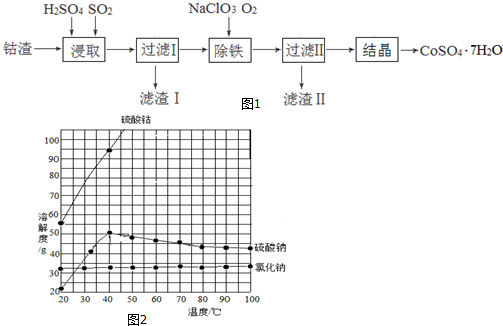
分析 钴渣在稀硫酸溶液中酸浸且通入二氧化硫气体,酸性条件下Co(OH)3、Fe(OH)3被二氧化硫还原生成Co2+、Fe2+,过滤得到滤液I中含有Co2+、Fe2+,向滤液中加入氯酸钠且同时通入氧气,Co2+、Fe2+被氧化,调节溶液的pH值将铁离子转化为Fe(OH)3而除去,所以滤渣II为Fe(OH)3,氯酸钠被还原生成NaCl,根据溶解度曲线知,硫酸钴随着温度升高而增大,硫酸钠溶解度随着温度升高先升高后降低,氯化钠溶解度随着温度升高而变化不大,将滤液蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品,结合题目分析解答.
解答 解:钴渣在稀硫酸溶液中酸浸且通入二氧化硫气体,酸性条件下Co(OH)3、Fe(OH)3被二氧化硫还原生成Co2+、Fe2+,过滤得到滤液I中含有Co2+、Fe2+,向滤液中加入氯酸钠且同时通入氧气,Co2+、Fe2+被氧化,调节溶液的pH值将铁离子转化为Fe(OH)3而除去,所以滤渣II为Fe(OH)3,氯酸钠被还原生成NaCl,根据溶解度曲线知,硫酸钴随着温度升高而增大,硫酸钠溶解度随着温度升高先升高后降低,氯化钠溶解度随着温度升高而变化不大,将滤液蒸发浓缩、趁热过滤、冷却到40℃结晶操作得到CoSO4•7H2O粗产品,
(1)酸性条件下,氢氧化钴被二氧化硫还原生成二价钴离子,同时生成硫酸根离子和水,离子方程式为2Co(OH)3+2H++SO2=2 Co2++SO42-+4H2O,
故答案为:2Co(OH)3+2H++SO2=2 Co2++SO42-+4H2O;
(2)除铁过程中,若选用氧化性更强的NaClO除铁,次氯酸钠具有强氧化性,能氧化钴离子而导致得不到CoSO4•7H2O,所以不能选取NaClO作氧化剂,
故答案为:氧化性过强会使Co2+被氧化;
(3)通过以上分析知,滤渣II为Fe(OH)3,
故答案为:Fe(OH)3;
(4)过滤后得到的滤液II中含有硫酸钴、硫酸钠、氯化钠,且硫酸钴溶解度随着温度升高而增大,20-40℃硫酸钠溶解度随着温度升高而增大,40℃后硫酸钠溶解度随着温度升高而降低,氯化钠溶解度随着温度升高变化不大,所以要从溶液中得到硫酸钴晶体,应该采用蒸发浓缩、趁热过滤,冷却到40℃结晶操作得到CoSO4•7H2O粗产品,防止硫酸钴析出而降低产率,冷却到40℃结晶,因为该温度下硫酸钴溶解度降低较大,硫酸钠溶解度较小,防止析出硫酸钠晶体,
故答案为:蒸发浓缩、趁热过滤;防止析出硫酸钠晶体.
点评 本题考查物质制备,为高考常考查方式,明确流程图中发生的反应、物质分离提纯方法及物质性质是解本题关键,侧重考查学生分析判断、识图及理解应用能力,易错点是(4)题分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 编号 | A的初始浓 度/(mol•L-1) | B的初始浓 度/(mol•L-1) | 生成C的初始速 率/(mol•L-1•s-1) |
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 1.0 | 2.0 | 4.8×10-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
香蕉水主要用作喷漆的溶剂和稀释剂,其主要成分乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
| 物质名称 | 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
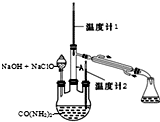 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CO (g )+O2(g )═2CO2(g );△H=-556kJ•mol-1 | |
| B. | CH4(g )+2O2 (g )═CO2(g )+2H2O (l );△H=-890kJ•mol-1 | |
| C. | 2H2(g )+O2(g )═2H2O(l );△H=-571.6kJ•mol-1 | |
| D. | 2H2(g )+2 Cl2 (g )═4HCl (g);△H=-369.2kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com