������Ļ�ѧ��Ӧ���ǿ��淴Ӧ��
��һ���ݻ�Ϊ2.0L�Ĺ̶��ݻ����ܱ������У�����һ���¶ȣ���һ�������½������·�Ӧ��A��g��+2B��g��?3C��g�������������м���2.0mol A��6.0molB����Ӧ������2minʱ�ﵽƽ�⣬��ʱ������3.0molC��
��1����B��Ũ�ȱ仯����ʾ�ķ�Ӧ����v��B��=
���÷�Ӧ�ڴ������µĻ�ѧƽ�ⳣ��K=
������÷�����ʾ����
��2������ͬʵ�������£�����ͬһ�����м���2.0molA��8.0molB����Ҫ��ƽ���C�ڷ�Ӧ�����������������䣬��Ӧ����C
mol��
��3������ͬʵ�������£�����ͬһ�����м���3.0molA��һ������B��ƽ��ʱC�����ʵ���Ϊ3.0mol��������B�����ʵ���Ϊ
mol��
���ں���������ʵ���Һ�У������ж����ѧƽ��森
��1�������£���0.2mol/L��ijһԪ��HA��Һ��0.1mol/L NaOH��Һ�������Ϻ���ҺpH����7�������Һ�����������Һ���֮�ͣ�����Һ�����й�ϵ��ȷ����
��
A�� c��HA����c��A
-��
B��c��HA��һ������0.1mol/L
C�� c��Na
+��=c��HA��+c��A
-��
D��c��OH
-��=c��H
+��+
[c��HA��-c��A
-��]

��2����������20mL0.1mol/L Na
2CO
3��Һ����μ���0.1mol/L HCl��Һ40mL����Һ�к�̼Ԫ�صĸ�������CO
2���ݳ�δ���������ʵ������������ᣩ����ҺpH�仯�IJ��������ͼ��ʾ���ش��������⣺
����ͬһ��Һ�У�H
2CO
3��HCO
3-��CO
32-������ܡ����ܡ���
�������森
�ڵ�pH=7ʱ����Һ�и������������ʵ���Ũ��֮��ĵ�����ϵ�ǣ�
��
����֪��25��ʱ��CO
32-ˮ�ⷴӦ��ƽ�ⳣ����ˮ�ⳣ��K
h=
=2��10
-4������Һ��c��
HC����c��
C��=2��1ʱ����Һ��pH=
��

 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��






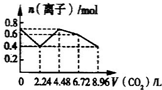
 ��ͼ��һ�ֿɳ�������ӵ�س䡢�ŵ�Ĺ���ʾ��ͼ���õ�صķ�ӦʽΪ��
��ͼ��һ�ֿɳ�������ӵ�س䡢�ŵ�Ĺ���ʾ��ͼ���õ�صķ�ӦʽΪ��