
分析 ①在金属活动顺序表中,排在前面的金属可从盐溶液中置换出后面的金属,铁排在铜的前面,硫酸铜和铁发生置换反应,反应生成硫酸亚铁和铜;
②氯气具有强氧化性,铁在氯气中燃烧生成氯化铁;
③铝粉与氧化铁粉末(Fe2O3)混合在引燃条件下发生反应,产生高温的同时生成氧化铝(A12O3)和铁(液态,用于焊接);
④铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
⑤铜和稀硝酸反应生成硝酸铜,一氧化氮和水.
解答 解:①在金属活动顺序表中,铁排在铜的前面,硫酸铜和铁发生置换反应,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu,
故答案为:Fe+CuSO4═FeSO4+Cu;
②氯气能将金属氧化为最高价,铁在氯气中燃烧的产物是氯化铁,反应为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
③Fe2O3与Al粉混合物发生铝热反应,实质是置换反应,生成铁和氧化铝,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3:;
④铝与NaOH溶液反应生成偏铝酸钠和氢气,化学反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
⑤铜具有还原性,稀硝酸具有氧化性,铜与稀硝酸发生氧化还原反应,生成硝酸铜,一氧化氮和水,反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查了化学方程式的书写,题目难度不大,注意掌握反应原理和化学方程式的书写方法,该题是高考中的高频题,侧重对学生基础能力的培养和训练.


科目:高中化学 来源: 题型:解答题
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
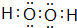 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
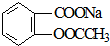 转变为
转变为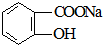 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 类比对象 | 结论 |
| A | 2F2+2H2O═4HF+O2 | 2I2+H2O═4HI+O2↑ |
| B | C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑ | 3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ |
| C | Na2O+H2O═2NaOH | FeO+H2O═Fe(OH)2 |
| D | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
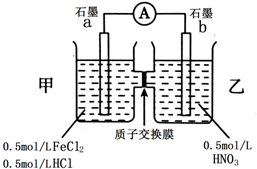
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com