
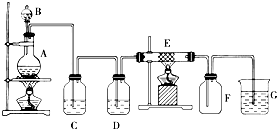
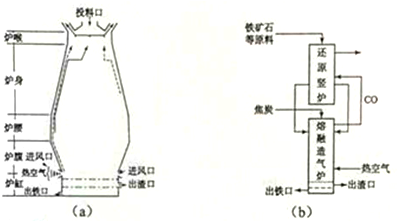
分析 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,利用二氧化锰和浓盐酸加热生成,生成的氯气中含氯化氢和水蒸气,C、D为气体净化装置,C中是饱和食盐水除去氯化氢气体,D中浓硫酸是吸收水蒸气干燥气体,E硬质玻璃管中装有细铁丝网,氯气和铁加热反应生成黄色固体氯化铁;F为干燥的空广口瓶;烧杯G为尾气吸收装置,
(1)依据分析可知装置D中浓硫酸吸收水蒸气干燥气体,氯气有毒需要进行尾气处理,氯气能够与氢氧化钠反应,可以用G装置中氢氧化钠溶液吸收过量的氯气;
(2)铁在氯气中点燃生成氯化铁,F中现象产生棕黄或棕褐色的烟;
(3)A、E、G中发生反应分别为二氧化锰和浓盐酸加热反应生成氯气的反应,铁和氯气加热反应生成氯化铁,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
解答 实验室用加热浓盐酸与二氧化锰反应制取氯气,浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到干燥的氯气,应依次通过盛有饱和食盐水、浓硫酸的洗气瓶,分别去掉氯化氢和水,氯气具有强的氧化性,能够与铁反应生成氯化铁,氯气有毒需要进行尾气处理,氯气能够与氢氧化钠反应,可以用氢氧化钠溶液吸收过量的氯气,
(1)依据分析可知C为除去氯化氢装置,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择饱和食盐水除去氯气中的氯化氢,所以C中试剂为饱和食盐水,氯气中含水蒸气,利用装置D中浓硫酸吸收水蒸气干燥气体,氯气有毒需要进行尾气处理,氯气能够与氢氧化钠反应,可以用氢氧化钠溶液吸收过量的氯气,所以G中试剂为氢氧化钠溶液;
故答案为:浓硫酸;氢氧化钠溶液;
(2)氯气具有强的氧化性,能够与铁反应生成氯化铁,铁在氯气中点燃生成氯化铁,F中现象产生棕黄或棕褐色的烟,
故答案为;产生棕黄或棕褐色的烟;
(3)A、E、G中发生反应分别为二氧化锰和浓盐酸加热反应生成氯气的反应,铁和氯气加热反应生成氯化铁,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,A中二氧化锰与浓盐酸加热生成氯气、氯化锰和水,方程式:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
E中铁在氯气中燃烧生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
G中尾气吸收,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;Cl2+2NaOH=NaCl+NaClO+H2O;
点评 本题考查了氯气的实验室制备、净化和性质检验,熟悉制备原理及氯气的性质是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
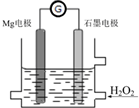 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水溶液的浓度等于氢氧化钠溶液 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | c(NH3•H2O)+c(NH4+)=0.01 mol•L-1 | |
| D. | 往等体积的两溶液中加入盐酸恰好中和,消耗盐酸多的溶液pH值小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研发可降解高分子材料,减少“白色污染” | |
| B. | 明矾和ClO2都能作为净水剂,其原理完全相同 | |
| C. | 海水淡化和工业生产及生活废水的再生利用,是解决缺水问题的有效途径 | |
| D. | 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉有效成分的化学式:Ca(ClO)2 | |
| B. | 亚硫酸的电离方程式:H2SO3═2H++SO32- | |
| C. | NO、NO2都是酸性氧化物 | |
| D. | Na+的结构示意图: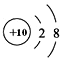 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
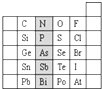 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.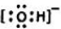 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com