
分析 ①充入N2使其浓度增大,平衡向正方向移动,达到新平衡后,N2的浓度为c mol/L,则c<b,又因为增大N2的浓度,所以a最小;
②缩小反应体系体积使压强增大到P2,此时平衡向气体体积减小的方向即正反应方向移动,达到新平衡后体系的压强为P3,则P3<P2,又因为增大压强,所以P1最小;
③温度升高到T2,此时平衡向吸热反应方向即逆反应方向移动,达到新平衡后 体系的温度为T3,则T3<T2,又因为升高温度,所以T1最小.
解答 解:①充入N2使其浓度增大,平衡向正方向移动,达到新平衡后,N2的浓度为c mol/L,则c<b,又因为增大N2的浓度,所以a最小,则a、b、c的大小为a<c<b,故答案为:正反应;a<c<b;
②缩小反应体系体积使压强增大到P2,此时平衡向气体体积减小的方向即正反应方向移动,达到新平衡后体系的压强为P3,则P3<P2,又因为增大压强,所以P1最小,则P1、P2、P3 的大小为P1<P3<P2;故答案为:正反应;P1<P3<P2;
③温度升高到T2,此时平衡向吸热反应方向即逆反应方向移动,达到新平衡后 体系的温度为T3,则T3<T2,又因为升高温度,所以T1最小,所以T1、T2、T3 的大小为T1<T3<T2,故答案为:逆反应; T1<T3<T2.
点评 本题综合考查化学平衡知识,侧重于平衡移动的判断分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
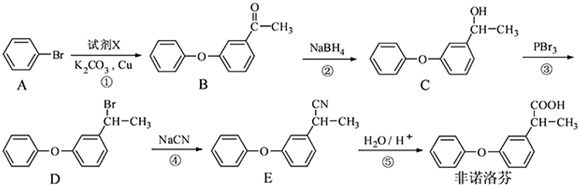
 .
. .
.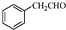 为原料制备
为原料制备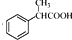 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
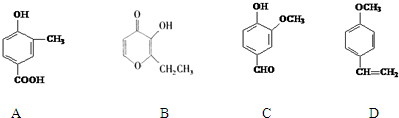
 ;
;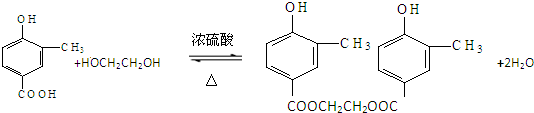 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写成B与足量NaHCO3溶液完全反应的化学方程式:
;写成B与足量NaHCO3溶液完全反应的化学方程式: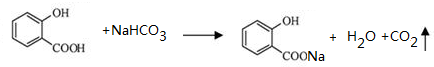 .
. .
. )是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
)是一种重要的有机合成中间体.根据图中提示的信息,试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++Cl-+3O2- | B. | H2SO4═2H++SO42- | ||
| C. | Mg(NO3)2═Mg2++2NO3- | D. | Na2SO4═2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3kJ/mol(中和热) | |
| C. | 2NO2=O2+2NO△H=+116.2kJ/mol(反应热) | |
| D. | S(s)+O2(g)═SO2(g)△H=-296.8kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com