

 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr分析 (1)苯在铁做催化剂时可以和溴发生取代反应获得溴苯;
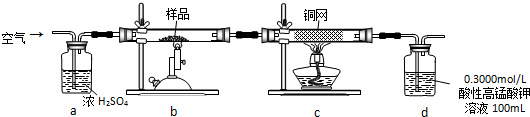
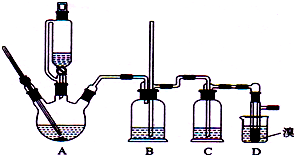
(2)根据压强差产生气泡判断装置气密性;
(3)氢溴酸是强酸,水可以阻止物质的溢出,起到水封的作用;
(4)溴乙烷的密度大于水;
(5)由图可知,A中发生 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,装置D的锥形瓶中小试管内苯(或四氯化碳)吸收溴,锥形瓶内的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子;
+HBr,装置D的锥形瓶中小试管内苯(或四氯化碳)吸收溴,锥形瓶内的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子;
(6)检验某溴乙烷中的溴元素,可以将溴乙烷碱性水解,再将溶液调成酸性,再检验溴离子即可;
解答 解:(1)苯在铁做催化剂时可以和溴发生取代反应获得溴苯,发生反应的原理方程式为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,
+HBr,
故答案为: +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr;
+HBr;
(2)步骤①中检验装置气密性的具体做法是组装好装置后,在U型右边导管口连接一个管带有胶管的玻璃导管,将导管放入水面下,加热烧瓶,若导管口处有气泡产生,停止加热后导管内有一段水柱产生,证明装置的气密性良好,
故答案为:组装好装置后,在U型右边导管口连接一个管带有胶管的玻璃导管,将导管放入水面下,加热烧瓶,若导管口处有气泡产生,停止加热后导管内有一段水柱产生,证明装置的气密性良好;
(3)溴化氢极易溶于水,形成的氢溴酸是强酸,水可以阻止易挥发物质HBr的溢出,起到水封的作用,
故答案为:溶解吸收溴化氢气体,防止溴化氢及产物逸出污染环境;
(4)溴乙烷的密度大于水,所以反应完毕后,U型管内液体分层,溴乙烷在下层,
故答案为:下;
若发生加反应不生成副产物,若发生取代反应生成HBr,
(5)由图可知,A中发生 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr,装置D的锥形瓶中小试管内苯(或四氯化碳)吸收溴,锥形瓶内的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子,所以①装置D的锥形瓶中,小试管内的液体是 CCl4,其主要作用是吸收挥发出来的溴蒸气,②反应后向锥形瓶中滴加 硝酸银溶液(或紫色石蕊试液),若 硝酸银溶液(或紫色石蕊试液)证明该反应为取代反应,
+HBr,装置D的锥形瓶中小试管内苯(或四氯化碳)吸收溴,锥形瓶内的液体为水,吸收HBr气体,然后滴加硝酸银检验溴离子,所以①装置D的锥形瓶中,小试管内的液体是 CCl4,其主要作用是吸收挥发出来的溴蒸气,②反应后向锥形瓶中滴加 硝酸银溶液(或紫色石蕊试液),若 硝酸银溶液(或紫色石蕊试液)证明该反应为取代反应,
故答案为:苯(或四氯化碳);吸收挥发出来的溴蒸气;硝酸银溶液(或紫色石蕊试液);有淡黄色沉淀产生(或紫色石蕊试液变红);
(6)检验某溴乙烷中的溴元素,可以将溴乙烷碱性水解,再将溶液调成酸性,再检验溴离子即可,其操作为加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察有无浅黄色沉淀生成,
故选D.
点评 本题考查了溴苯和溴乙烷的制取,这是一个综合性较强的实验题,连续制备两种产品溴苯和溴乙烷,需要根据题意及装置图示,联系所学知识合理分析完成,本题难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲乙两容器均为恒容容器,则x必等于2 | |
| B. | 若甲乙两容器均为恒压容器,则x必等于3 | |
| C. | 若甲为恒压容器,乙为恒容容器,且x不等于3,则n1必大于n2 | |
| D. | 若甲为恒容容器,乙为恒压容器,且x等于3,则n1必大于n2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com