
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难,其原因是___________________________。
再失去一个电子难,其原因是___________________________。
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成![]() 分子:价电子总数
分子:价电子总数![]() 的价电子数
的价电子数![]() 提供电子数
提供电子数![]() .Fe原子也能与CO形成配合物,其化学式为________.
.Fe原子也能与CO形成配合物,其化学式为________.
(5)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______![]() 填“a”或“b”
填“a”或“b”![]() ;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(6)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
【答案】![]() CO2或N2O等合理答案 Mn2+3d能级为半充满结构,较稳定,不易失去电子。 Fe(CO)5 b
CO2或N2O等合理答案 Mn2+3d能级为半充满结构,较稳定,不易失去电子。 Fe(CO)5 b ![]() pm
pm ![]()
【解析】
(1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,根据构造原理书写Fe核外价电子排布式;
(2)原子个数相等且价电子数相等的分子或离子为等电子体;
(3)Mn2+的价电子为3d5,3d轨道半充满,较稳定;Fe2+的价电子为3d6,不稳定;
(4)铁元素,价电子数为8,根据18电子规则,它可以结合5个CO形成配合物;
(5)由晶胞示意图可知,a为面心立方最密堆积,b为体心立方最密堆积,若单质Fe按a方式紧密堆积,Fe原子的半径为rpm,故晶胞棱长为![]() pm;
pm;
(6)根据密度ρ=m/V进行计算。
(1)Fe是26号元素,其原子核外有26个电子,铁原子失去2个电子生成Fe2+,其3d轨道上6个电子为其外围电子,其价层电子排布图为![]() ,故答案为:
,故答案为:![]() 。
。
(2)SCN-中含有3个原子,且其价电子数是16,与SCN-互为等电子体的一种分子为CO2、N2O、CS2、COS等,故答案为:CO2、N2O、CS2、COS等合理答案。
(3)Mn元素为25号元素,价电子的排布式为:3d54s2;Mn2+的价电子为3d5,3d轨道半充满,较稳定,由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;Fe2+的价电子为3d6,不稳定,由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,故答案为:Mn2+3d能级为半充满结构,较稳定,不易失去电子。
(4)铁元素,价电子数为8,每个配体提供的电子数是2,8+2n=18,n=5,它可以结合5个CO形成配合物,所以铁元素形成的配合物的化学式为Fe(CO)5,故答案为:Fe(CO)5。
(5)由晶胞示意图可知,a为面心立方最密堆积,b为体心立方最密堆积,若单质Fe按a方式紧密堆积,Fe原子的半径为rpm,故晶胞棱长为![]() pm,故答案为:b;
pm,故答案为:b;![]() pm。
pm。
(6)根据晶胞结构可知含有铁原子的个数为12×1/4+1=4,硫原子个数为8×1/8+6×1/2=4,晶胞边长为anm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为ρ=m/V=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作____剂。
(2)自然界Cr主要以+3价和+6价存在。Cr2O72-的Cr能引起细胞的突变,在酸性条件下可以用亚硫酸钠将其还原为+3价的铬,写出其离子方程式_____________________________________________ :
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是______________。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①上述操作中有多次过滤,其中玻璃棒的作用__________ ,向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为____。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是____。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
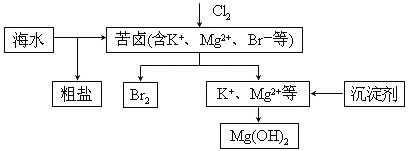
A. 向苦卤中通入Cl2是为了提取溴
B. 工业生产中常选用NaOH作为沉淀剂
C. 粗盐可采用除杂和重结晶等过程提纯
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫单质的水可治皮肤病,而硫难溶于水,微溶于酒精,易溶于![]() ,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是
A. ![]() B. 氯仿C.
B. 氯仿C. ![]() D. 酒精
D. 酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有少量Na2O2的试管中加入蒸馏水,得到溶液a | 反应剧烈,产生能使带火星木条复燃的气体 |
然后向溶液a中滴入两滴酚酞 | 溶液先变红,再逐渐变浅,约10分钟溶液变为无色 |
为了探究溶液变为无色的原因,该同学按照科学的程序,进行了如下实验:
(推理与假设)
Na2O2与H2O反应的化学方程式_____。向溶液a中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。由此提出如下的假设:
假设A:O2有漂白性 假设B:NaOH有漂白性 假设C:O2和NaOH共同作用有漂白性
(实验与观察)
(2)请完成下表:
实验编号 | 1 | 2 | 3 |
实验装置 |
|
|
|
实验假设 (填“A”、“B”或“C”) | 假设_____ | 假设____ | 假设__ |
实验现象 | 溶液变红后10分钟均无变化 | ||
实验结论 | _____ | ||
(查阅资料)
该同学查阅资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
(推理与假设)
该同学认为褪色的原因可能是溶液a中存在H2O2,H2O2漂白了酚酞。
(实验与观察)
(3)通过实验证实了H2O2的存在:取少量溶液a,加入黑色粉末____(填化学式),快速产生了能使带火星木条复燃的气体。该同学进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案:取少量溶液a于试管中,_____。
(解释与结论)
(4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
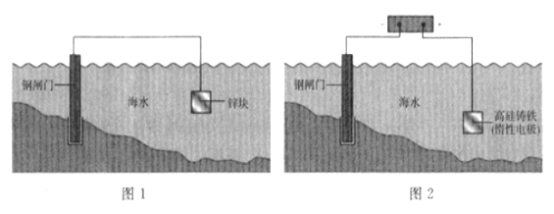
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有2.8gFe全部溶于一定浓度、200ml的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe3+形式存在
D. 1.12L气体只能是NO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com