
分析 CH4气体的燃烧热△H=-802kJ•mol-1,根据燃烧热的概念可知,1molCH4气体完全燃烧生成1molCO2和H2O(L)时,放出的热量为802KJ,1molCH4气体不完全燃烧生成1molCO和H2O(L)时,放出的热量为519KJ,故1molCO燃烧生成1molCO2,放出的热量为802kJ-519kJ=283kJ,1mol甲烷不完全燃烧与完全燃烧相比,减少的热量为生成的CO燃烧放出的热量,根据减少的热量计算生成n(CO),再根据C原子守恒计算生成n(CO2),根据H原子守恒计算n(H2O),最后利用氧原子守恒计算n(O),利用m=nM计算氧原子的质量,等于消耗的氧气质量.
解答 解:(1)1molCH4气体不完全燃烧生成1molCO和H2O(L)时,放出的热量为519KJ,反应的热化学方程式为:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1038KJ/mol;
答:CH4气体不完全燃烧的热化学方程式为2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1038KJ/mol;
(2)1molCH4与一定量氧气燃烧生成CO,CO2,H2O(L),并放出731.25KJ的热量,减少的热量为802KJ-731.25KJ=70.75kJ,
1mol甲烷不完全燃烧与完全燃烧相比,减少的热量为生成的CO燃烧放出的热量,故生成n(CO)=$\frac{70.75KJ}{283KJ}$×1mol=0.25mol
根据C原子守恒可知n(CO2)=1mol-0.25mol=0.75mol,根据H原子守恒可知n(H2O)=$\frac{1mol×4}{2}$=2mol,利用氧原子守恒由n(O)=0.25mol+0.75mol×2+2mol=3.75mol,故消耗的氧气的质量为3.75mol×16g/mol=60g;
答:n值为60g.
点评 本题考查反应热的有关计算,利用常规方法非常麻烦,本题解法关键是理解甲烷不完全燃烧与完全燃烧相比,减少的热量为生成的CO燃烧放出的热量,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 100:1 | C. | 1:100 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑧ | B. | ①⑥ | C. | ②④ | D. | ③⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


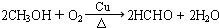 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
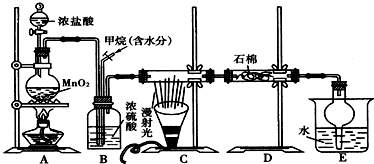
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2 FeO42-+3Cl-+H2O+4H+ | |
| B. | 碳酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-=NH3•H2O | |
| C. | NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | |
| D. | 把少量碳酸氢钠溶液加入到氢氧化钡溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com