

分析 (1)碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔;
(2)根据盖斯定律及已知热化学方程式写出目标热化学方程式;
(3)由图象得,250℃,催化剂的催化效率最好,之后催化剂的催化效率急剧降低,据此进行分析;据温度低,能耗低,节约经济成本;
(4)①根据Qc与k的相对大小分析;
②催化剂表面积较大,反应速率快,达到平衡所用时间短;
③由图象可知,NO的浓度减小,平衡向正方向移动;
(5)①第二步氧化剂氯气氧化氨氮物质即氨气生成N2的过程,发生的反应为:3Cl2+2NH3=N2+6HCl;
②3Cl2+2NH3=N2+6HCl~6mole-,据此方程式进行计算.
解答 解:(1)碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,配平即可,反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)已知①2NH3(l)+CO2(g)═H2NCOONH4(氨基甲酸铵)(l)△H1=-272.0kJ•mol-1
②H2NCOONH4(l)═H2O(l)+H2NCONH2(l)△H2=+138.0kJ•mol-1,
根据盖斯定律,①+②可得:2NH3(l)+CO2(g)═H2O(l)+H2NCONH2 (l),△H=-272.0kJ•mol-1+138.0kJ•mol-1=-134.0kJ•mol-1,
故答案为:2NH3(l)+CO2(g)=H2O(l)+H2NCONH2 (l)△H=-134.0kJ•mol-1;
(3)由图象得,250~300℃时,温度升高而乙酸的生成速率降低的原因是250℃,催化剂的催化效率最好,之后催化剂的催化效率急剧降低;250℃和400℃时乙酸的生成速率几乎相等,由于温度低,能耗低,节约经济成本,故实际生产中应选择的温度为250℃,
故答案为:250℃,催化剂的催化效率最好,之后催化剂的催化效率急剧降低;250;
(4)①起始时,NO为0.4mol,平衡时NO为0.2mol,
2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2
起始物质的量:0.4mol 0.4mol 0 0
转化的物质量:0.2mol 0.2mol 0.2mol 0.1mol
平衡物质的量:0.2mol 0.2mol 0.2mol 0.1mol
则平衡时的浓度:c(NO)=0.1mol/L,c(CO)=0.1mol/L,c(CO2)=0.1mol/L,c(N2)=0.05mol/L,
该稳定性该反应的平衡常数K=$\frac{0.{1}^{2}×0.05}{0.{1}^{2}×0.{1}^{2}}$=5;
平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,则c(CO)=0.5mol/L,c(N2)=0.45mol/L,
此时的浓度商Qc=$\frac{0.{1}^{2}×0.45}{0.{1}^{2}×0.{5}^{2}}$=1.8<k,则平衡将向右移动,
故答案为:向右;
②催化剂表面积较大,反应速率快,达到平衡所用时间短,由图可知,b曲线代表的条件下反应速率快,所以b的催化剂的表面积大;
故答案为:b;
③由图象可知,NO的浓度减小,平衡向正方向移动,所以改变的条件为增加CO的物质的量浓度或增大压强;
故答案为:增大CO的物质的量浓度(或增大压强);
(5)①第二步氧化剂氯气氧化氨氮物质即氨气生成N2的过程,发生的反应为:3Cl2+2NH3=N2+6HCl,
故答案为:3Cl2+2NH3=N2+6HCl;
②m(NH3)=0.034%×1t=340g,
3Cl2+2NH3=N2+6HCl~6mole-
34 6
340 60,则n(e-)=60mol,故N(e-)=60NA,
故答案为:60NA.
点评 本题考查较为综合,涉及化学平衡的计算、反应热与焓变、电子转移的计算及化学方程式的书写,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析、理解能力及化学计算能力.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 通过电解熔融CD3可以制备C单质 | |
| B. | A和B可以形成气体,其分子一定为正四面体结构 | |
| C. | C的氢氧化物可以溶于D的最高价氧化物的水化物 | |
| D. | A2B2O4在水中可电离出阳离子和阴离子,所以A2B2O4中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeSO4在空气中放置变质 | B. | 氯水、AgI密封保存在棕色试剂瓶中 | ||
| C. | SO2使品红和酸性KMnO4溶液褪色 | D. | 常温下浓硝酸不能溶解Al和Au(金) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁元素主要以单质的形态存在于自然界中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在实验室中用浓盐酸与MnO2共热制取Cl2.
在实验室中用浓盐酸与MnO2共热制取Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
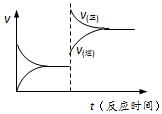 已知:
已知:| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.4mol AgNO3受热完全分解(2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.2NA | |
| B. | 6.4g CaC2中含有的离子总数目为0.3NA | |
| C. | 1 mol FeI2与一定量氯气反应时,若已知有1mol Fe2+被氧化则转移的电子数为3NA | |
| D. | 1mol 苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 113号元素的氧化物为碱性氧化物 | |
| B. | 115号元素位于第七周期VA族 | |
| C. | 含176个中子的Ts原子表示为${\;}_{117}^{176}$Ts | |
| D. | 118号元素的原子最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com