
| A、1L 1.0mol?L-1的NaC1O溶液中含有C1O-的数目为NA |
| B、标准状况下,22.4L盐酸含有NA个HC1分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molNa被完成氧化生成Na2O2,失去个2NA电子 |


科目:高中化学 来源: 题型:
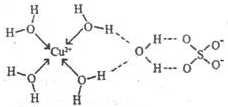 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.| 元素 | Mn | Fe | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
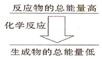 化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因.生成物中化学键形成时会
化学反应中均伴随着能量的变化,化学键的断裂和形成是发生能量变化的主要原因.生成物中化学键形成时会查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L |
| B、2.5mol/L |
| C、1.5mol/L |
| D、1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在有盐桥构成的铜-锌-稀硫酸原电池中,盐桥中的阳离子移向电池的锌极 |
| B、化学平衡的建立与途径无关,可以从正反应方向建立,也可以从逆反应方向建立 |
| C、可以借助分光度计采用比色的方法测定某反应的化学反应速率 |
| D、在FeCl3与过量的KI溶液充分反应后的溶液用CCl4萃取后,往上层溶液中加入几滴KSCN溶液,溶液出现血红色,说明该化学反应存在限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保持容器体积不变,升高温度,混合气体的颜色逐渐变深 |
| B、恒温,恒容,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C、恒温,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=2.5mol/L |
| D、恒温、恒压,再通入2mol HI气体,到达平衡状态后,HI转化率会提高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com