
下列关于硫及其化合物的说法中正确的是( )。
A.自然界中不存在游离态的硫
B.二氧化硫的排放会导致光化学烟雾的产生
C.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
D.浓硫酸可用来干燥SO2、CO、Cl2等气体
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
已知25 ℃时,AgI 饱和溶液中[Ag+]为1.22×10-8 mol·L-1,AgCl的饱和溶液中[Ag+]为1.30×10-5 mol·L-1。若在5 mL含有KCl和KI浓度均为
饱和溶液中[Ag+]为1.22×10-8 mol·L-1,AgCl的饱和溶液中[Ag+]为1.30×10-5 mol·L-1。若在5 mL含有KCl和KI浓度均为
0.01 mol·L-1的混合溶液中,滴加8 mL 0.01 mol·L-1的AgNO3溶液,则下列叙述中不正确的是 ( )
A.反应后溶液中离子浓度大小关系为:[NO3-]>[Ag+]>[Cl-]>[I-]
B.溶液中先产生的是AgI沉淀
C.AgCl的Ksp的数值为1.69×10-10
D.若在AgCl悬浊液中滴加KI溶液,白色沉淀会转变成黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原电池、电解池的电极名称,下列说法错误的是( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有( )。
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法正确的是( )。
①除去乙烷中少量的乙烯:光照条件下通入Cl2,分离 ②除去乙酸乙酯中的少量乙酸:用饱和碳酸钠溶液洗涤,分液 ③除去硝基苯中混有的浓硝酸和浓硫酸:可向混合物中加入氢氧化钠溶液,分液 ④除去乙醇中的少量乙酸:加足量生石灰,蒸馏
A.①②③ B.①②④
C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究新制饱和氯水的组成和性质而进行了如下科学实验:先观察了氯水的外观性质以后,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。请回答下列问题:
(1)写出新制饱和氯水中含有氯元素物质的化学式:
__________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:____________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①__________________________________________。
②__________________________________________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
[实验步骤]
①取试管内的无色溶液3 mL盛于另一支洁净的试管中;
②________________,振荡试管。
[实验现象及结论]
①若________________,则证明溶液红色褪去的原因是①而不是②;
②若________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
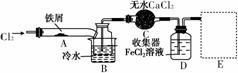
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为____________________________________________________________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是____________________________________________________________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)____________。
(4)装置B中冷水浴的作用为____________________________________________________________;
装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:____________________________________________________________。
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为____________________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;
②____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中,反应速率最快的是( )
| 组号 | 反应温度/℃ | Na2S2O3 | H2SO4 | H2O | ||
| 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | 浓度/ mol·L-1 | 体积/ mL | ||
| A | 10 | 5 | 0.2 | 5 | 0.1 | 10 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO |
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
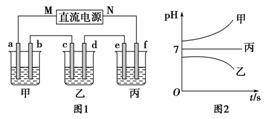
(1)M为直流电源的________极,b电极上发生的电极反应为__________________________________________________________。
(2)计算e电极上生成的气体在标准状况下的体积为________。
(3)写出乙烧杯中的总反应的离子方程式:__________________________________________________________。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量)____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com