
���÷�Ӧ6NO2��8NH3��7N2��12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��
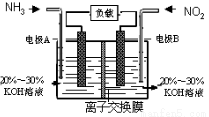
����˵������ȷ����
A���������Ҳ�缫�������غ��������缫
B��Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
C���缫A����ӦʽΪ��2NH3��6e����N2��6H��
D������4.48LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.8mol
C
��������
�����������ȼ�ϵ������Ϊȼ�ϣ��ڷ�Ӧ�а�ʧȥ���ӣ�����صĸ������ұ߽���������õ����ӣ���Ϊ��ص�����������У��������Ǵӵ�ص����������صĸ�������A��ȷ����ȼ�ϵ�س����ŵ�ʱ���ڵ�صĸ������ĵ����������ӣ����ڵ�ص������������������ӣ����������ɵ�����������Ӧ�ô��������ƶ����Ա�֤�������㹻������������Ӳ��뷴Ӧ��������ӽ���Ĥ��ѡ�������ӽ���Ĥ����B��ȷ���������Һ�ʼ��ԣ�A����ӦʽΪ��2NH3��6e��+6OH-��N2��6H2O����C����1mol��������ת��4mol���ӣ�����4.48LNO2(��״��) ������ʱ��ת�Ƶ���Ϊ0.8mol����D��ȷ��
���㣺ȼ�ϵ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�������������ۿ��Ի�ѧ�Ծ��������棩 ���ͣ������
(16��)̼���仯�����й㷺����;��
��1�� ��ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ
C(s)��H2O(g)  CO(g)��H2(g)����H����131.3 kJ��mol��1��
CO(g)��H2(g)����H����131.3 kJ��mol��1��
���Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ���������H2O��ƽ��ת���ʵ���________��(�����)
A�������¶� B������̼������ C��������� D����CO���ռ���ȥCO
��2�� ��֪��C(s)��CO2(g)  2CO(g)����H����172.5 kJ��mol��1����CO(g)��H2O(g)
2CO(g)����H����172.5 kJ��mol��1����CO(g)��H2O(g)  CO2(g)��H2(g)���ʱ䦤H��________��
CO2(g)��H2(g)���ʱ䦤H��________��
��3�� CO��H2��һ�������¿ɷ�Ӧ���ɼ״���CO(g)��2H2(g) =CH3OH(g)���״���һ��ȼ�ϣ������ü״����һ��ȼ�ϵ�أ���ϡ�������������Һ�����ʯī���缫���õ�ظ�����ӦʽΪ_______________��
���øõ���ṩ�ĵ��ܵ��60 mL NaCl��Һ������0.01 mol CH3OH��ȫ�ŵ磬NaCl�������ҵ�������Cl2ȫ���ݳ������ǰ�������Һ����ı仯�����������������Һ��pH��________��
��4�� ��һ������CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2.0 L�ĺ����ܱ������У��������·�Ӧ��
CO(g)��H2O(g)  CO2(g)��H2(g)���õ��������ݣ�
CO2(g)��H2(g)���õ��������ݣ�
�¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ���� ��ʱ��/min | ||
H2O | CO | H2 | CO |
| |
900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
ͨ����������÷�Ӧ��ƽ�ⳣ��(���������λ��Ч����)________���ı䷴Ӧ��ijһ��������Ӧ���е�t minʱ����û��������CO2�����ʵ���Ϊ0.6 mol������200 mL 5 mol/L��NaOH��Һ������ȫ���գ���Ӧ�����ӷ���ʽΪ(��һ�����ӷ���ʽ��ʾ)________________________��
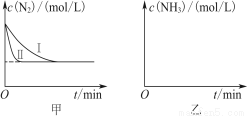
��5�� ��ҵ�����ǰ�ˮú���еĻ�����徭���������õĽϴ�H2���ںϳɰ����ϳɰ���Ӧԭ��ΪN2(g)��3H2(g)  2NH3(g)����H����92.4 kJ��mol��1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯��ͼ����ʾ��
2NH3(g)����H����92.4 kJ��mol��1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯��ͼ����ʾ��
��ش��������⣺����ʵ���Ƚϣ�ʵ���ı������Ϊ____________________��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ������ͼ���л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�����и�����ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪C��s��+H2O��g���T CO��g��+H2��g�� ��H=akJ?mol��1
2C��s��+O2��g���T 2CO��g�� ��H=��220kJ?mol��1
H��H��O=O��O��H���ļ��ֱܷ�Ϊ436��496��462kJ?mol��1����aΪ
A����332 B����118 C��+350 D��+130
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ��������ϰ�ࣩ10���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼװ�ÿ���������ȡ��ϴ�ӡ�����ռ�(������β������)���塣��װ�ÿ�����
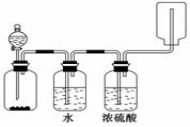
A��п�������Ʊ�����
B������������Ũ�����Ʊ�����
C��̼��ƺ������Ʊ�������̼
D���Ȼ��ƺ�Ũ�����Ʊ��Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ������
��10�֣�һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ�
��1���������з�Ӧ���Խ�����ת��Ϊ���ȴ�99.9%�ĸߴ�����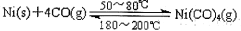 ����÷�Ӧ�ġ� H 0��ѡ�������������
����÷�Ӧ�ġ� H 0��ѡ�������������
��2���ڸ�����һ����̼�ɽ���������ԭΪ��������֪��
C(s)��O2(g)��CO2(g) �� H 1����393.5kJ��mol��1
CO2(g)��C(s) ��2CO(g) �� H 2����172.5kJ��mol��1
S(s)��O2(g) ��SO2(g) �� H 3����296.0kJ��mol��1
��д��CO��SO2���Ȼ�ѧ����ʽ ��
��3����ҵ����һ����̼��ȡ�����ķ�ӦΪ��CO(g)��H2O(g) CO2(g)��H2(g)����֪420��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ9.0�������Ӧ��ʼʱ����2L���ܱ������г���CO ��H2O�����ʵ�������0.60mol��5minĩ�ﵽƽ�⣬���ʱCO��ת����Ϊ ��
CO2(g)��H2(g)����֪420��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ9.0�������Ӧ��ʼʱ����2L���ܱ������г���CO ��H2O�����ʵ�������0.60mol��5minĩ�ﵽƽ�⣬���ʱCO��ת����Ϊ ��
��4����ͼ��һ������ȼ�ϵ��,����COΪȼ�ϣ�һ��������Li2CO3��Na2CO3���ڻ����Ϊ����ʣ�ͼ2�Ǵ�ͭ������װ��ͼ������ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�顣�ش��������⣺
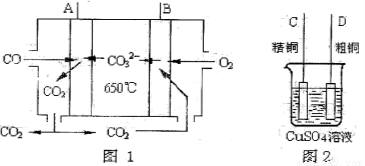
��д��A�������ĵ缫��Ӧʽ ��
��Ҫ��ȼ�ϵ��Ϊ��Դ���д�ͭ�ľ���ʵ�飬��B��Ӧ���� �����C����D����������
�۵����ı�״����2.24LCOʱ��C�缫�������仯Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪����ʵ����ʵ
��Cr2O3�����������KOH��Һ�õ�KCrO2��Һ��������������õ�Cr2(SO4)3��Һ��
����KCrO2��Һ�еμ�H2O2��Һ�����ữ���ɵ�K2Cr2O7��Һ��
�۽�K2Cr2O7��Һ�μӵ����ۺ�KI�Ļ����Һ�У���Һ������
�����жϲ���ȷ����
A��������KCrO2��CrԪ��Ϊ+3��
B��ʵ���֤��Cr2O3������������
C��ʵ���֤�������ԣ�Cr2O72����I2
D��ʵ���֤��H2O2�������������л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015���Ĵ�ʡ�ɶ�����������11��ͳһ��⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ȷ����
A��NH4Cl��CaC2�������ӻ�����
B����̼��ԭ���γɵ�ij�ֻ�����Ƚ��ʯ����Ӳ������Ҫԭ����̼������̼̼������
C����ΪҺ̬�������д����⽡����������ӱ��Ȼ�����ȶ�
D������AijԪ�ص�ԭ������Ϊm����ͬ���ڢ�AԪ�ص�ԭ�������п���Ϊm+10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ�����������¿���ѧ�Ծ��������棩 ���ͣ������
(10��)ƫ��������N2O4�dz��õĻ���ƽ��������߷������»�ѧ��Ӧ��
(CH3)2NNH2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(g) (��)
2CO2(g)+3N2(g)+4H2O(g) (��)
��1����Ӧ(��)���������� ��
��2������к��г��ֺ���ɫ���壬ԭ��Ϊ��N2O4(g) 2NO2(g) (��)���¶�����ʱ��������ɫ�����Ӧ(��)Ϊ (����ȡ����ȡ�)��Ӧ��
2NO2(g) (��)���¶�����ʱ��������ɫ�����Ӧ(��)Ϊ (����ȡ����ȡ�)��Ӧ��
��3��һ���¶��£���Ӧ(��)���ʱ�Ϊ��H���ֽ�1 mol N2O4����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬���� ��
������ͬ�¶��£�������Ӧ�������Ϊ1 L�ĺ����ܱ������н��У�ƽ�ⳣ�� (����������䡱��С��)����Ӧ3 s��NO2�����ʵ���Ϊ0��6 mol����0 s��3 s�ڵ�ƽ����Ӧ����v(N2O4)= mol��L-1��s-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�켪��ʡ����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ӷ�Ӧ���͵ĽǶ����������л�ѧ��Ӧ�У��������������Ͳ�ͬ����( )
A��п����ϡ���ᷴӦ��ȡ����
B������Ͷ������ͭ��Һ������ͭ
C��������Ͷ��ˮ�в�����������������
D��һ����̼�������������������ɽ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com