
| A. |  | B. |  | ||
| C. | 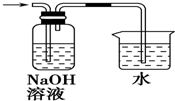 | D. | 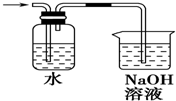 |
科目:高中化学 来源: 题型:选择题
 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )| A. | 重金属离子可导致蛋白质变性 | |
| B. | 苯是最简单的芳香烃 | |
| C. | 向空气中大量排放SO2和NxOy都能引起酸雨和光化学烟雾 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
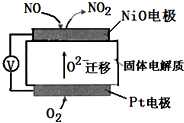 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )| A. | Pt 电极上发生的是氧化反应 | |
| B. | O2-向正极迁移 | |
| C. | 负极的电极反应式为:NO-2e-+O2-=NO2 | |
| D. | 正极的电极反应式为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为18.4 mol•L-1 | |
| B. | 该硫酸与等体积的水混合后所得溶液的质量分数大于49% | |
| C. | 配制200mL 4.6 mol•L-1的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的物质的量浓度大于9.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的原子数目为NA.
的原子数目为NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述II |
| A | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
| B | SiO2导电能力强 | 可用于制造通讯光缆 |
| C | Al有还原性,在某些反应中热效应大 | 利用铝热反应冶炼金属Mn |
| D | 常温下铁与浓硫酸、浓硝酸均不反应 | 可用铁槽车密封运送浓硫酸、浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com