
| A. | 常温常压下,氯气呈气态而溴单质呈液态 | |
| B. | 硝酸是挥发性酸,硫酸是难挥发性的酸 | |
| C. | 稀有气体一般难发生化学反应 | |
| D. | 氮气在常温下很稳定,化学性质不活泼 |
分析 A.根据组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高;
B.硝酸、硫酸和磷酸固态时都属分子晶体,熔、沸点的高低由分子间作用力的大小决定;
C.稀有气体为单原子分子,原子都是稳定结构;
D.物质的稳定性与键能有关.
解答 解:A.氯气的相对分子质量比溴单质小,所以氯气的沸点比溴单质低,在常温常压下氯气呈气态而溴单质呈液态,与键能无关,故A错误;
B.硝酸的分子间作用力小,沸点低,是挥发性,酸硫酸、磷酸的分子间作用力大,沸点高,是不挥发性酸,与键能无关,故B错误;
C.稀有气体为单原子分子,原子都形成稳定结构,稀有气体一般难于发生化学反应,与键能无关,故C错误;
D.氮气分子中N≡N的键能很大,分子很稳定,故氮气在常温下很稳定,化学性质不活泼,与键能有关,故D正确;
故选D.
点评 本题考查化学键和分子间作用力这两个不同概念,需要注意的是物质的稳定性与键能有关,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 编号 | (1) | (2) | (3) | (4) |
| 反应速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 )分子中有5n个σ键
)分子中有5n个σ键| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12LSO3所含的原子数是0.2NA | |
| B. | 3.9gNa2O2吸收足量的CO2时转移电子数是0.05NA | |
| C. | 20g重水中含有中子数为8NA | |
| D. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
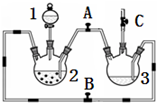 某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.
某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色.提供化学药品:铁粉、稀硫酸、氢氧化钠溶液.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③⑥⑦⑧ | C. | ⑤⑥⑦⑧ | D. | ④⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com