
某有机物的结构简式如图:
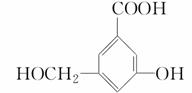
(1)当和________________反应时,可转化为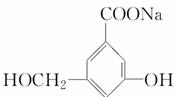 。
。
(2)当和________________反应时,可转化为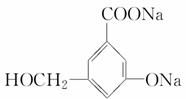 。
。
(3)当和________________反应时,可转化为 。
。
科目:高中化学 来源: 题型:
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol?L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol?L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol?L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I. 取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III. 向2 mL 0.1 mol?L-1 FeCl3溶液中滴加2滴0.1 mol?L-1 KSCN溶液,变红,通入O2,无明显变化。
① 实验I的说明 ;②实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 ① mol?L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的可能原因是 ② 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 | 试剂及操作 | 现 象 |
| i | ③ | 生成白色沉淀 |
| ii | 向i所得溶液中滴加0.1 mol?L-1 FeCl3溶液 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列混合物的除杂方法与发生反应的类型均正确的是( )
| 混合物 | 加入试剂或方法 | 反应类型 | |
| A | 除去O2中的CO | 通入炽热的氧化铜中 | 化合反应 |
| B | 除去CO2中的HCl | 通入饱和碳酸氢钠溶液中 | 复分解反应 |
| C | 除去碳酸钙中的碳酸钠 | 溶解、加入氯化钡溶液 | 复分解反应 |
| D | 除去氯化钠中的碳酸钠 | 加入适量盐酸、蒸发 | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在学习了乙酸的性质后,根据甲酸的结构(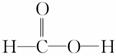 )对甲酸的化学性质进行了下列推断,其中不正确的是
)对甲酸的化学性质进行了下列推断,其中不正确的是
( )
A.能与碳酸钠溶液反应
B.能发生银镜反应
C.不能使KMnO4酸性溶液褪色
D.能与单质镁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
分子组成为C3H5O2Cl的含氯有机物A,与NaOH水溶液反应并将其酸化,得到分子组成为C3H6O3的有机物B,在适当条件下,每两分子B可以相互发生酯化反应生成1分子C,那么C的结构不可能是
( )
A.CH3CH(OH)COOCH(CH3)COOH
B.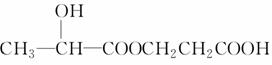
C.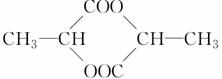
D.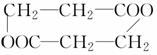
查看答案和解析>>
科目:高中化学 来源: 题型:
不属于四种基本反应类型的氧化还原反应是( )
A.2KMnO4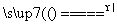 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
B.2Na+Cl2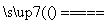 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.Fe2O3+3CO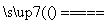 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下发生下列反应
(1)16H+ +10Z-+ 2XO-4 ===2X2++ 5Z2+ 8H2O (2) 2A2十+B2==2A3++ 2B- (3) 2B- +Z2==B2+2Z-
根据上述反应,判断下列结论中错误的是:( )
A.溶液中可能发生:Z2+2A2+==2A3++2Z- B.Z2在①、③反应中均为氧化剂
C.氧化性强弱顺序为:XO-4>Z2>B2>A3+ D.X2+是XO-4的还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com