
| A. | 已知X在一定条件下转化为Y,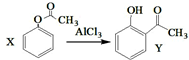 ,X与Y互为同系物,可用FeBr3溶液鉴别 ,X与Y互为同系物,可用FeBr3溶液鉴别 | |
| B. | 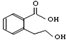 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 能发生的反应类型有:加成反应、取代反应、消去反应、氧化反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物有5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
分析 A.X、Y分子式相同,但结构不同,Y含有酚羟基,可发生显色反应;
B.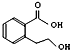 含有羧基、羟基,结合酸、醇的性质判断;
含有羧基、羟基,结合酸、醇的性质判断;
C.写出该有机物的结构简式,然后判断其分子中等效氢原子数目,等效氢原子种类与一氯代物种类相同;
D.乙酸乙酯不溶于水,易溶于乙醇.
解答 解:A.X、Y分子式相同,但结构不同,属于同分异构体,Y含有酚羟基,可发生显色反应,可用氯化铁鉴别,故A错误;
B. 含有羧基、羟基,能发生取代反应、消去反应,羟基能发生氧化反应,含有苯环,能发生加成反应,故B正确;
含有羧基、羟基,能发生取代反应、消去反应,羟基能发生氧化反应,含有苯环,能发生加成反应,故B正确;
C.3-甲基-3-乙基戊烷的结构简式为:CH3CH2C(CH3)(CH2CH3)CH2CH3,该有机物碳架为: ,分子中含有4种碳原子,其中④号C不含H原子,所以分子中含有3种等效氢原子,其一氯代物有3种,故C错误;
,分子中含有4种碳原子,其中④号C不含H原子,所以分子中含有3种等效氢原子,其一氯代物有3种,故C错误;
D.乙酸乙酯不溶于水,易溶于乙醇,故D错误.
故选B.
点评 本题考查了有机物结构和性质,为高频考点,侧重于学生的分析能力的考查,题目涉及有机物的鉴别,同分异构体的判断,题目难度中等,注意掌握同系物、同分异构体的概念,明确常见有机物结构与性质,能够对常见有机物的命名作出正确判断.


科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 某温度下,KSP(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12;将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液,则先产生Ag2CrO4沉淀 | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] | |
| D. | 在0.1 mol•L-1氨水中滴加0.1 mol•L-1盐酸,刚好完全中和时pH=a,则由水电离产生的c(H+)=10-amol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯 | |
| B. | 棉花、羊毛、蚕丝和麻等是天然纤维 | |
| C. | 高聚物 中的官能团是酯基 中的官能团是酯基 | |
| D. | 可以用溴水鉴别乙醛和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该栀子酯的分子式C10H11O2 | |
| B. | 1mol栀子酯水解需要消耗2mol NaOH | |
| C. | 栀子酯可以发生加成、取代和消去反应 | |
| D. | 栀子酯的一氯代物有六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O为直线型分子 | |
| B. | 反应中每生成1molS转移了2mol电子 | |
| C. | NaHS中含离子键和非极性键 | |
| D. | 琉单质(S8)为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | Fe(碘) | - | 加热 |
| B | 二氧化碳(氯化氢) | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式 | |
| D. | 反应①属于酯水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com