
| Ԫ�� | �����Ϣ |
| X | X������������Ӧ��ˮ���ﻯѧʽΪH2XO3 |
| Y | Y�ǵؿ��к�����ߵ�Ԫ�� |
| Z | ZԪ�ص�ԭ���������3������ |
| W | W��һ�ֺ��ص�������Ϊ28��������Ϊ14 |
| A�� | Wԭ�Ӱ뾶����Z | |
| B�� | ��Ԫ�ؿ�����X��Y�ֱ��γɵĶ�Ԫ��������Ӽ������γ���� | |
| C�� | ��Z���������ᷴӦ�����ɫ��Һ�еμ�NaOH��Һֱ������������ | |
| D�� | W�ĵ���������ᷴӦ����������ɫ���� |
���� X��Y��Z��W��Ԫ�����ڱ���ԭ������������������ֶ�����Ԫ�أ�Y�ǵؿ��к�����ߵ�Ԫ�أ�YΪOԪ�أ�ZԪ�ص�ԭ���������3�����ӣ���ZΪAlԪ�أ�X������������Ӧ��ˮ���ﻯѧʽΪH2XO3��Ϊ̼�ᣬ��֪XΪCԪ�أ�W��һ�ֺ��ص�������Ϊ28��������Ϊ14����������Ϊ28-14=14��WΪSiԪ�أ��Դ������
��� �⣺������������֪��XΪC��YΪO��ZΪAl��WΪSi��
A��ͬ���ڴ�������ԭ�Ӱ뾶��С����Wԭ�Ӱ뾶С��Z����A����
B��C���⻯����Ӽ䲻�������ˮ���Ӽ京�������B����
C���Ȼ�����NaOH��Һ��Ӧ�������ɰ�ɫ������NaOH����ʱ������ʧ����C����
D��Si��HF�ᷴӦ����SiF4��H2������������ɫ���壬��D��ȷ��
��ѡD��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɣ�Ϊ��Ƶ���㣬����ԭ��������ԭ�ӽṹ��Ԫ�صĺ����ƶ�Ԫ��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���ۼ� | C-C | C�TC | C-H | H-H |
| ����/��kJ•mol-1�� | 348 | 610 | 413 | 436 |
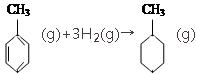 ���ʱ�
���ʱ�| A�� | �٢ڢۢ� | B�� | �ۢܢ� | C�� | �ܢ� | D�� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
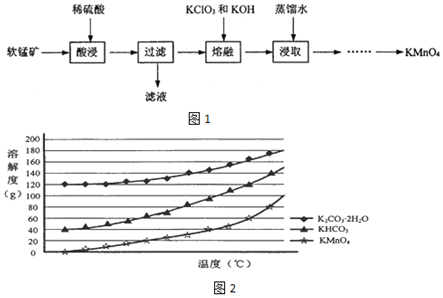
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ͨ��������Ҫԭ�����ռʯ��ʯ��ʯӢ | |
| B�� | SiO2�ǹ��ά����Ҫ�ɷ֣����������������뵼����� | |
| C�� | ʵ�����ô����������Լ�ƿ��������������Һ | |
| D�� | ���������跴Ӧ���ʲ�������Ϊ��Һ�ⵥ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ÿ����1mol Fe3O4ת��4mol���� | |
| B�� | �÷�Ӧ��Fe2+��S2O32-���ǻ�ԭ�� | |
| C�� | 3mol Fe2+������ʱ��1molO2����ԭ | |
| D�� | ��Ӧ����ʽ�л�ѧ������x=4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BaSO3��ϡHNO3��Ӧ��3BaSO3+2H++2NO3-�T3BaSO4+2NO��+H2O | |
| B�� | ̼������Һ�еμ�������ˮ�����ӷ���ʽΪ��CO32-+Cl2+H2O=HCO3-+Cl-+HClO | |
| C�� | Fe2��SO4��3��Һ��Ba��OH��2��Һ��Ӧ��Fe3++SO42-+Ba2++3OH-�TFe��OH��3��+BaSO4�� | |
| D�� | ��FeI2��Һ�еμ�������ˮ����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2�T2Fe3++2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ͬѹ����ͬ�¶��µķ�Ӧ��A��g��+B��g��?C��g����H��A�ĺ������¶ȵĹ�ϵ��ͼ��ʾ�����н�����ȷ���ǣ�������
ͬѹ����ͬ�¶��µķ�Ӧ��A��g��+B��g��?C��g����H��A�ĺ������¶ȵĹ�ϵ��ͼ��ʾ�����н�����ȷ���ǣ�������| A�� | T1��T2����H��0 | B�� | T1��T2����H��0 | C�� | T1��T2����H��0 | D�� | T1��T2����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ħ�������ʵ����ĵ�λ������6.02��1023���������ʽ���1Ħ�� | |
| B�� | 1mol������6.02��1023����ԭ�� | |
| C�� | 1mol����������ѹǿ������¶Ƚ��Ͷ���С | |
| D�� | ��״���£������ȵ�CCl4��Cl2��ǰ�ߺ��е���ԭ�����Ǻ��ߵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | V��N2��=0.01mol/��L•S�� | B�� | V��H2��=0.2mol/��L•S�� | ||
| C�� | V��H2��=0.6mol/��L•min�� | D�� | V��NH3��=1.2mol/��L•min�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com