
| A、3:1 | B、1:3 |
| C、2:3 | D、3:2 |
| 2.4×2 |
| 1 |
| V |
| Vm |
| 2.4×2 |
| 1 |
| 6x+4y |
| x+y |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H2O、H2CO3、NaOH都是氧化物 |
| B、食用醋、冰红茶、加碘盐都是混合物 |
| C、烧碱、纯碱、熟石灰都属于碱 |
| D、氧气、氯气、铁单质都是常用氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
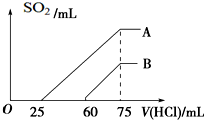 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、研制常温下分解水制取氢能的催化剂 |
| B、提高煤液化制取汽油的技术水平 |
| C、推广汽车用燃料以天然气替代汽油 |
| D、研究提高汽油燃烧热的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、4.2g |
| C、3.6g | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑧? | B、①②③⑤⑥⑧⑩ |
| C、②⑥⑦⑨ | D、④? |
查看答案和解析>>
科目:高中化学 来源: 题型:
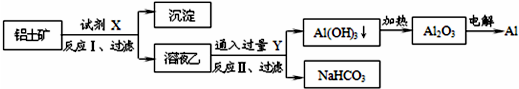
| A、试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C、结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
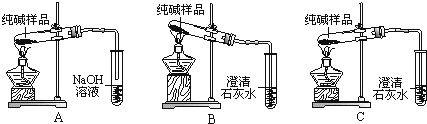
查看答案和解析>>
科目:高中化学 来源: 题型:
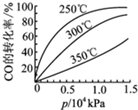 高炉炼铁过程中发生的主要反应为
高炉炼铁过程中发生的主要反应为| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com