
已知下列反应:反应Ⅰ:Co2O3 + 6HCl(浓)= 2CoCl2 + Cl2↑+ 3H2O
反应Ⅱ:5Cl2 + I2 + 6H2O=10HCl + 2HIO3 下列说法正确的是
+ 6H2O=10HCl + 2HIO3 下列说法正确的是
A.反应Ⅰ中HCl是氧化剂
B.反应Ⅱ中Cl2发生氧化反应
C.反应Ⅰ中氧化剂与还原剂的物质的量之比为1:6
D.氧化性:Co2O3 > Cl2 >HIO3
 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:2016届湖北省枣阳市高三上学期10月月考理综化学试卷(解析版) 题型:选择题
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是
A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅
B.煤经过气化和液化两个物理变化,可变为清洁能源
C.如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100 nm之间
D.将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期10月阶段性教学质检化学试卷(解析版) 题型:选择题
粒子甲在溶液中的转化关系如下图所示,粒子甲不可能是

A.NH4 + B.Al(OH)3 C.S D.Al
查看答案和解析>>
科目:高中化学 来源:2016届四川省德阳市高三上学期10月月考理综化学试卷(解析版) 题型:填空题
Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + a Na2O2 = 2Na2FeO4 + b X + 2Na2SO4 + c O2↑
该反应中物质X应是 ________ ,b与c的关系是 _____________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: ________________。
②每生成1mol FeO42-转移 _______mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 ______ mo1。
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是________________________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c为________________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省杭州市高三上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.二氧化硅的结构式:O =Si= O
B.H2O沸点高于NH3,是因为H2O分子间存在氢键而NH3分子间不存在氢键
C.含有金属离子的晶体一定是离子晶体
D.分子晶体中一定存在分子间作用力,不一定存在共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
250 ℃和1.01×105 Pa时,反应2N2O5(g) == 4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于能量效应
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期期中测试理综化学试卷(解析版) 题型:实验题
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设①该反应的气体产物是CO2;②该反应的气体产物是CO。
③该反应的气体产物是 。
(2)设计方案,如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
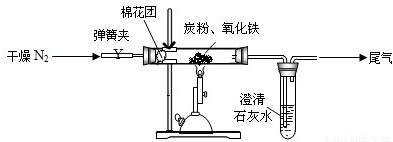
(3)查阅资料
氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
请写出该反应的离子方程式: 。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为 。
(5)数据处理
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式: 。
(6)实验优化 学习小组有同学认为应对实验装置进一步完善。
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是 。
②从环境保护的角度,请你再提出一个优化方案将此实验装置进一步完善: 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省新安江校区高三上学期第二次模拟化学试卷(解析版) 题型:填空题
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。
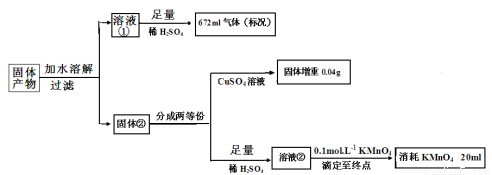
(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
查看答案和解析>>
科目:高中化学 来源:2016届山东省邹城市高三上学期10月月考化学试卷(解析版) 题型:选择题
在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达正确的是
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
A.abc B.bcd C.abcd D.acd
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com