
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡 | |
| D. | 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应 |
分析 A.碱性溶液能使湿润的红色石蕊试纸变蓝,气体溶于水呈碱性;
B.一元弱酸HA的Ka 越大,电离出氢离子浓度越大酸性越强;
C.水的离子积常数只与温度有关,酸碱抑制水电离,含有弱根离子的盐促进水电离;
D.硅是非金属单质,可以和强碱溶液反应.
解答 解;A.碱性溶液能使湿润的红色石蕊试纸变蓝,所以某气体能使湿润的红色石蕊试纸变蓝,则该气体水溶液显碱性,故A正确;
B.一元弱酸HA的Ka 越大,电离平衡状态下氢离子浓度越大酸性越强,故B错误;
C.水的离子积常数只与温度有关,温度不变,溶液中水的离子积常数不变,酸碱抑制水电离,含有弱根离子的盐促进水电离,所以向水中加入酸、碱抑制水的电离,影响水的电离平衡,盐可能影响水的电离,如强酸强碱盐不影响水的电离,如加入氯化钠,加入含弱离子的盐会促进水的电离,如Na2CO3,故C错误;
D.硅常温下也能与氢氧化钠溶液等强碱溶液反应,生成硅酸盐和氢气,故D错误;
故选A.
点评 本题综合考查弱电解质电离平衡、离子积常数影响因素、氨气和硅单质性质等问题,侧重于对弱电解质电离平衡应用的理解,题目难度中等,注意相关知识的把握.


科目:高中化学 来源: 题型:选择题
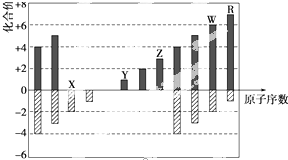
| A. | 原子半径:Z>Y>X | |
| B. | WX3和水反应形成的化合物是离子化合物 | |
| C. | R的单质可以从W的气态氢化物的水溶液中置换出W的单质 | |
| D. | Z的最高价氧化物对应的水化物既能溶解于盐酸,又能溶解于氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 被还原的硝酸的物质的量是0.12mol | |
| C. | 得到5.08g沉淀时,加入NaOH溶液的体积是700mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 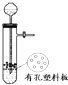 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 图所示装置用于Cu和浓H2SO4反应制取少量的SO2气体 | |
| B. | 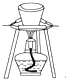 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 图所示装置用于除去碳酸氢钠固体中的少量碳酸钠 | |
| C. | 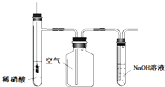 图所示装置用于制备并收集NO气体 图所示装置用于制备并收集NO气体 | |
| D. | 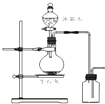 图所示装置制取并收集氨气 图所示装置制取并收集氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
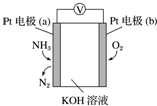 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com