
|
下列实验中金属或氧化物可以完全溶解的是 | |
| [ ] | |
A. |
1 mol锌片与含1 mol HCl的稀溶液混合 |
B. |
1 mol MnO2粉末与含4 mol HCl的浓盐酸共热 |
C. |
常温下1 mol铝片投入足量的浓硫酸中 |
D. |
常温下1 mol铜片投入含4 mol HNO3的浓硝酸中 |
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高一上学期期中考试化学试卷(解析版) 题型:填空题
铁是重要的常见金属材料,也是人类较早使用的金属之一。请运用铁及其化合物的知识,完成下列问题。
(1)铁路大提速后,为将短铁轨焊接成长铁轨,可在铁轨接口处加入四氧化三铁和铝粉的混合物,用镁条引燃发生反应,写出发生置换反应的化学方程式并用单线桥法标出电子转移__________________;
(2)向20mL的沸蒸馏水中逐滴滴加5~6滴0.1mol/L的FeCl3溶液,继续煮沸没有观察到透明的红褐色现象,请问此时分散系中粒子直径的范围是______nm,判断的依据是_________________________;
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________。
(4)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,提出如下假设:
a.只含________________________(填写溶质化学式)。
b.可能组成为___________________(填写溶质化学式)。
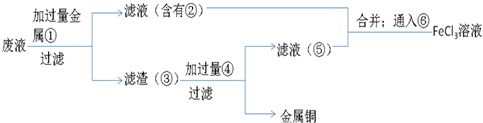
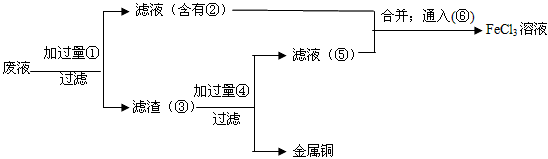
(5)欲从废腐蚀液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:

请写出上述实验中加入或生成的有关物质的化学式:
①__________ ③_____________④___________
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:月考题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com