
【题目】25℃时,将0.1mo/L的NaOH溶液滴入盛有50mL pH= 2的H A溶液的绝热容器中,加入NaOH溶液的体积V与溶液温度T的关系如下图。下列说法正确的是
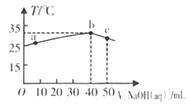
A. a点溶液中,c(A-)+ c(HA)= 0.08mol/L.
B. b点溶液中,c(A-)<c(Na+))
C. b → c的过程中,发生了吸热反应
D. 溶液中HA的电离平衡常数a点等于b点
【答案】B
【解析】酸碱中和放热,b点温度最高,所以b点是NaOH与HA恰好反应的点;40mL0.1mo/L的NaOH溶液与50mL pH= 2的H A溶液恰好反应,所以HA的浓度是![]() 0.08mo/L。根据物料守恒,a点溶液中c( A-)+ c(HA)=
0.08mo/L。根据物料守恒,a点溶液中c( A-)+ c(HA)= ![]() 0.067 mol/L ,故A错误;0.08mo/L的HA溶液pH= 2,说明HA是弱酸,NaA是强碱弱酸盐,所以b点溶液中c( A-)<c(Na+),故B正确;b
0.067 mol/L ,故A错误;0.08mo/L的HA溶液pH= 2,说明HA是弱酸,NaA是强碱弱酸盐,所以b点溶液中c( A-)<c(Na+),故B正确;b![]() c的过程没有发生反应,温度降低的原因是35℃的NaA溶液中又加入10mL 25℃的NaOH溶液,故C错误;b点温度大于a点,所以HA的电离平衡常数a点小于b点,故D错误。
c的过程没有发生反应,温度降低的原因是35℃的NaA溶液中又加入10mL 25℃的NaOH溶液,故C错误;b点温度大于a点,所以HA的电离平衡常数a点小于b点,故D错误。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是( )
A. 乙烯、聚乙烯均能使溴水褪色
B.  和
和 互为同分异构体
互为同分异构体
C. 苯在催化剂作用下能与浓硝酸发生取代反应
D. 等质量的甲烷和乙烯完全燃烧,乙烯消耗的O2多![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.001mol/L的酸性高锰酸钾溶液滴定未知浓度的草酸(H2C2O4)溶液,回答下列 问题:
(1)酸性高锰酸钾溶液应该装在下图__________滴定管中。

(2)请写出该反应的离子方程式:____________________。
(3)用0.001mol/L的酸性高锰酸钾溶液滴定草酸溶液,滴定终点的判断依据是:_________________。
(4)己知滴定V1ml待测液消耗标准液实验数据如下表
实验次数 | 始读数(ml) | 末读数(ml) | 消耗体积 |
1 | 0.10 | 19.20 | 19.10 |
2 | 1.85 | 20.75 | 18.90 |
3 | 0.00 | 24.06 | 24.06 |
则待测液的浓度为:_______________
(5)滴定结束时,俯视刻度线读取高锰酸钾溶液的体积,会导致测定结果_________(填“偏大”“偏小”或“不影响”)
(6)己知NaHC2O4溶液中草酸氢根离子的电离大于水解,则溶液中各离子的浓度按由大到小的顺序排列的是:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。
(1)工业上进行海水淡化有多种方法。
①蒸馏法是历史最久,技术和工艺比较成熟的海水淡化方法。下图是海水蒸馏装置示意图,仪器B的名称是_________。

②下图是膜分离技术进行海水淡化的原理示意图。水分子可以透过淡化膜,而海水中其他各种离子不能通过淡化膜。加压后,右侧海水中减少的是_______(填序号)。

a. 溶质质量 b. 溶液质量 c. 溶剂质量 d. 溶质的物质的量浓度
(2)碘在海水中主要以I-的形式存在,而在地壳中主要以IO3-的形式存在(几种粒子之间的转化关系如下图)。

①海水为原料按方法i制取I2的离子方程式是___________________。已知I2可以与Cl2继续反应生成IO3-,由该法制取I2时应注意控制的反应条件是_______。
②以方法ii在溶液中制取I2,反应的离子方程式是(已知:反应后所得溶液显酸性)________。
③上图iii中反应后溶液中IO3-和Cl-的个数比为1:6,则该反应中氧化剂和还原剂的物质的量之比是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuI)是阳极射线管复盖物,也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
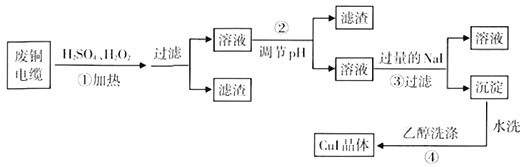
(1)过程①得到的溶液呈蓝色,其原因是______(用化学方程式表示),当温度高于40℃时,过程①反应速率减慢,原因是________________。
(2)过程②调节溶液pH适宜选用的试剂是_______(填正确答案的字母编号);已知25℃时,Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=4×10-35,lg2=0.30,则过程②调节溶液PH时,溶液的PH不小于________。
A.NaOH B.NH3·H2O C.CuO D.CuCO3
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为________________。
(4)过程④用乙醇洗涤沉淀的目的为________________。
(5)准确称取mg CuI样品,加入足量的Fe2(SO4)3溶液中,CuI被完全氧化生成Cu2+和I2。待样品完全反应后,用amol/L酸性KMnO4溶液滴定,达到终点时,消耗酸性KMnO4溶液的体积平均值为VmL。则样品中CuI的质量分数为_______(已知: 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是
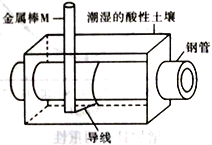
A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式不正确的是
A. 用碳酸钠溶液处理锅炉中的硫酸钙水垢:CaSO4(s)+ ![]() (aq)
(aq) ![]() CaCO3(s)+
CaCO3(s)+ ![]() (aq)
(aq)
B. 用加热的方法降低自来水中钙离子浓度:Ca2++2H![]()
![]() CaCO3 ↓+H2O+CO2↑
CaCO3 ↓+H2O+CO2↑
C. 用醋酸清洗热水壶中的碳酸钙水垢:2H++CaCO3=== Ca2++H2O+CO2↑
D. 用肥皂(主要成分C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO—+Ca2+ === (C17H35COO)2Ca↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com