
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。
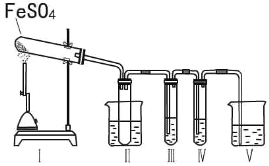
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在___(选填“0℃、25℃、50℃”),装置Ⅱ的作用是___________。
②装置Ⅲ中的试剂可以是________(选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是__________________。
A.2mol/LNa2CO3溶液 |
B.品红溶液 |
C.0.5mol/L BaCl2溶液 |
D.0.5mol/LBa(NO3)2 |
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为_____________。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入_______________ | _____________________ | 固体中含有Fe2O3 |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ______________ |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=______(精确到0.1%)
【答案】4FeSO4·7H2O + O2 = 4Fe(OH)SO4+26H2O 50℃,防止产生倒吸(或“用作安全瓶”) C 产生白色沉淀 B、E SO2+2OHˉ=SO32ˉ+H2O KSCN溶液(或硫氰化钾溶液) 溶液变成血红色 固体中含有FeO 35.7%。
【解析】
(1)新制的绿矾(FeSO4·7H2O)在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],Fe2+被空气中的氧气氧化成Fe3+,则该反应的化学方程式是4FeSO4·7H2O + O2 = 4Fe(OH)SO4+26H2O;
(2)①SO3的沸点是44.8℃,当温度高于44.8℃时三氧化硫为气体状态,把试管浸泡在50℃的热水浴中能防止SO3液化或凝固,产生的气体极易和溶液反应时,会产生倒吸,所以装置II的试管能防止溶液倒吸入装置Ⅰ中(或安全瓶),因此Ⅱ装置烧杯中水的温度应控制在50℃,装置Ⅱ的作用是防止产生倒吸(或“用作安全瓶”);
②装置III是检验是否有三氧化硫生成,可以选用氯化钡溶液,如果有白色沉淀生成说明有三氧化硫;装置IV是检验是否有二氧化硫,二氧化硫能使品红褪色,也能使酸性高锰酸钾溶液褪色,所以可以选用二者来检验二氧化硫;
③二氧化硫会污染空气,所以要用氢氧化钠溶液来吸收剩余的二氧化硫,其反应的离子方程式为:SO2+2OHˉ=SO32ˉ+H2O;
④检验三价铁离子用硫氰化钾溶液,溶液变红色,证明有三价铁离子,进而说明固体产物中含有氧化铁;检验二价铁离子用K3[Fe(CN)6]溶液,溶液中生成蓝色沉淀,说明有二价铁离子,即证明固体产物中含有FeO;
⑤反应过程中FeSO4固体分解为二氧化硫、三氧化硫、FeO、Fe2O3,完全分解后得到11.2g固体为氧化铁和氧化亚铁,质量减少的为二氧化硫和三氧化硫的总质量,设生成的二氧化硫为xmol,三氧化硫为ymol,根据硫元素守恒,则x+y=22.8g÷152g/mol=0.15mol,64x+80y=22.8g-11.2g=11.6g,解得:x=0.025,y=0.125,FeSO4固体分解,每生成1mol二氧化硫时硫元素得到2mol电子,每生成1mol Fe2O3时铁元素失去2mol电子,所以生成的二氧化硫与氧化铁的物质的量相同,则Fe2O3的物质的量为0.025mol,其质量为0.025mol×160g/mol=4.0g,质量分数为:(4.0g÷11.2g)×100%=35.7%。


科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物用途广泛。某兴趣小组拟制备氯气并验证其一系列性质。
I.(查阅资料)
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
II.(性质验证)
实验装置如图1所示(省略夹持装置)
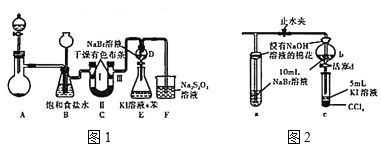
(1)装置A中盛放固体试剂的仪器是____;若分别用KMnO4、Ca(ClO)2、KClO3固体与足量的浓盐酸反应,则产生等量氯气转移的电子数之比为____。
(2)装置C中II处所加的试剂可以是____(填下列字母编号)
A.碱石灰 B.浓硫酸 C.硅酸 D.无水氯化钙
(3)装置B的作用有:除去氯气中的氯化氢、______、_____。
(4)不考虑Br2的挥发,检验F溶液中Cl-需要的试剂有_______。
III.(探究和反思)
图一中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为图2装置,实验操作步骤如下:
①打开止水夹,缓缓通入氯气;②当a和b中的溶液都变为黄色时,夹紧止水夹;
③当a中溶液由黄色变为棕色时,停止通氯气;④…
(5)设计步骤③的目的是______。
(6)还能作为氯、溴、碘非金属性递变规律判断依据的是_____(填下列字母编号)
A.Cl2、Br2、I2的熔点 B.HCl、HBr、HI的酸性
C.HCl、HBr、HI的热稳定性 D.HCl、HBr、HI的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设计的CO2资源化利用的装置如图所示(电解质溶液为稀H2SO4),下列说法错误的是
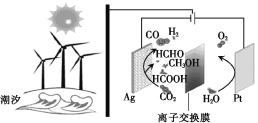
A.该离子交换膜为质子交换膜
B.Ag极上的电势比Pt极上的高
C.电路中每流过4 mol电子,阳极区质量减少36 g
D.太阳能、风能及潮汐能均是可再生能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2的结构简式为N≡C—C≡N,其化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间。下列有关反应的化学方程式不正确的是( )
A. (CN)2+H2=2HCN
B. MnO2+4HCN=Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN=2KI+(CN)2
D. 在NaBr和KCN混合液中通入少量Cl2:Cl2+2KCN=2KCl+(CN)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
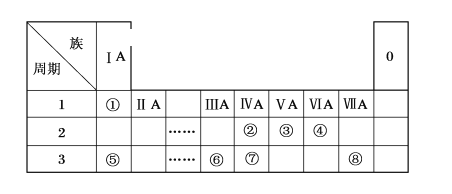
(1)④、⑤、⑥的原子半径由大到小的顺序是_____。(用元素符号表示)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____。
(3)③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒:A_____、B____、C_____、D____。并写出A、B、E三种微粒反应的离子方程式________。
(4)由④⑤⑧三种元素组成的某种盐是家用消毒液的主要成分,将该盐溶液滴入KI淀粉溶液中溶液变为蓝色,则反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂, 不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:Ksp(PbSO4)=1.82×l0-8;Ksp(PbCO3)=l.46×l0-13。
回答下列问题:
(1)加Na2CO3溶液转化的目的是_________.
(2)酸溶时,不直接使用H2SO4溶液的原因可能是________;铅与硝酸在酸溶过程中发生反应的离子方程式为__________.
(3)流程中可循环利用的物质是_________;洗涤操作时,检验沉淀是否洗涤干净的方法是________。
(4)当沉淀转化达平衡时,滤液l中c(SO42-)与c(CO32-)的比值为_____________。
(5) 50-60℃时合成三盐的化学方程式为______;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
B. 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置或操作进行的相应实验,能达到实验目的的是( )
A.用图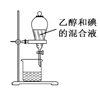 所示装置分离乙醇和碘的混合液
所示装置分离乙醇和碘的混合液
B.用图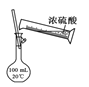 所示操作配制100 mL 0.1 mol·L-1硫酸溶液
所示操作配制100 mL 0.1 mol·L-1硫酸溶液
C.用图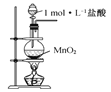 所示装置制取氯气
所示装置制取氯气
D.用图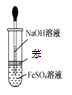 所示装置不能制取Fe(OH)2
所示装置不能制取Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com