
分析 (1)根据环境保护时不会产生污染环境的因素来判断;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)依据在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ和盖斯定律计算得到所需热化学方程式.
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×$\frac{1}{2}$+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×$\frac{1}{2}$+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×$\frac{1}{2}$+(-285.84KJ•mol-1)=-319.68KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1.
(3)由题意可写出热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1,
②4Al(s)+3O2(g)═2Al2O3(s)△H=-4b kJ•mol-1.
高温下铝置换碳的反应为:4Al+3CO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3C,
根据盖斯定律:②-①×3可得,4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),△H=(3a-4b)KJ/mol;
故答案为:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(3a-4b)KJ/mol.
点评 本题以废旧印刷电路板的回收利用为载体,考查了热化学方程式等知识,为高频考点,注意把握盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为提高反应速率,可换用98%的浓硫酸 | |
| B. | 在反应过程中,水的电离程度逐渐增大 | |
| C. | 在反应体系中加入硫酸钠溶液,反应速率不变 | |
| D. | 在反应体系中加入少量醋酸钠固体,反应速率变慢,生成氢气的量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:
现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、红褐色沉淀H,已知黄绿色气体乙为Cl2,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出),请根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
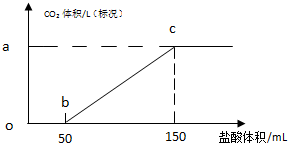
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
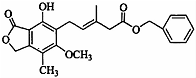
| A. | 分子中所有的原子共平面 | |
| B. | 既可以与FeCl3溶液发生显色反应.又可以与NaHCO3溶液反应放出CO2气体 | |
| C. | 1 mol该化合物最多可以与9mol H2发生加成反应 | |
| D. | 该物质能发生取代反应、氧化反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液在电流作用下电离出自由移动的离子 | |
| B. | 设阿伏加德罗常数为NA,则2.24LCO2气体中所含原子数目为0.3NA | |
| C. | 实验室里将少量金属钠保存在煤油中 | |
| D. | 向某无色溶液中加入少量BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则此溶液中一定有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com