
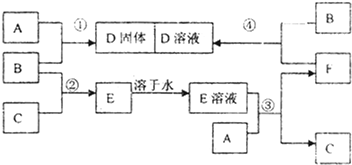
分析 单质B为黄绿色气体,则B为Cl2;C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl;A为金属固体单质,A与盐酸生成氢气,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe;结合转化关系可知F为FeCl2,D为FeCl3,据此进行解答.
解答 解:单质B为黄绿色气体,则B为Cl2;C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl;A为金属固体单质,A与盐酸生成氢气,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe;结合转化关系可知F为FeCl2,D为FeCl3,
(1)根据分析可知,A为Fe,B为Cl2,
故答案为:Fe;Cl2;
(2)反应①为Fe和Cl2的反应生成氯化铁,反应的化学方程式为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)反应③为Fe和HCl的反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2HCl=FeCl2+H2↑,
故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应生成氯化铁,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物的推断,题目难度中等,“单质A、B、C分别为常见金属单质、黄绿色气体、无色气体”为突破口,学习中注意元素化合物的性质及反应现象的掌握,试题有利于培养学生的分析、理解能力及逻辑推理能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol N4分子的质量是56 g | |
| B. | 标况下,NA个 H2O分子含有3NA个原子 | |
| C. | 常温下,1 mo/L 的NH4Cl 溶液中NH4+的浓度小于1 mol/L | |
| D. | 高温高压,催化剂条件下,28 g N2分子与6 g H2充分反应可生成34 g NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是负极,铜是正极 | B. | 电子从铜片经导线流向锌片 | ||
| C. | 负极的反应式为2H++2e-=H2 | D. | 反应一段时间后,溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水100℃和25℃的pH值 | |
| B. | Na2CO3溶液中2c(CO32-)和c(Na+) | |
| C. | 100mL 0.1mol/L的CH3COOH溶液与10mL 1.0mol/L的CH3COOH溶液中H+数目 | |
| D. | 同温下pH=11的KOH与pH=3的CH3COOH溶液中由水电离出的OH-离子浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
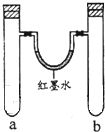 某化学小组用以下装置做兴趣实验(试管中有空气存在).
某化学小组用以下装置做兴趣实验(试管中有空气存在).| 实验编号 | a中试剂 | b中试剂 |
| 1 | 0.1克Na、3mL水 | 0.1克Na、3mL乙醇 |
| 2 | 铁钉、3mL饱和食盐水 | 铁钉、3mL饱和氯化铵 |
| 3 | 3mL水 | 3mL饱和FeSO4溶液 |
| 4 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O的结构式H-O-H.
H2O的结构式H-O-H.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com