
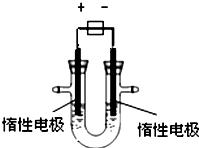
 (1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:
(1)用惰性电极电解CuSO4溶液(如图的装置),该过程中电解池电极反应式为是阳极:| 3.2g |
| 64g/mol |
| 0.1mol |
| 4 |


科目:高中化学 来源: 题型:
 常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示.以下叙述中不正确的是.( )
常温下将HA和HB两种一元酸的溶液分别加水稀释,稀释时溶液pH的变化如图所示.以下叙述中不正确的是.( )| A、HB是一种弱酸 |
| B、稀释前,c(HA)<10c(HB) |
| C、在NaB和HB的混合溶液中一定存在:c(B-)>c(Na+)>c(H+)>c(OH-) |
| D、在M点的两种溶液中:c(B-)=c(A-),且c(B-)+c(H+)>c(A-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
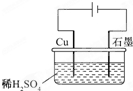
| A、电解过程中,铜电极上有H2产生 | ||||
B、电解初期,主反应方程式为:Cu+H2SO4
| ||||
| C、电解一定时间后,石墨电极上有铜析出 | ||||
| D、整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 |
若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 |
产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 棉球变白,微热后又恢复红色 | ||
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 结论:该气体具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫酸铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| B、碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
| C、往FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+ |
| D、氧化亚铁溶于稀硝酸:FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 稳定性:盐酸>硅酸 |
| B | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成血红色 | 溶液中含有Fe3+,没有Fe2+ |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
| D | 向盛有碘水的试管中加入CCl4后充分振荡静置 | 液体分层,上层基本无色,下层紫色 | 碘在CCl4中的溶解度较大 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com