
【题目】下列说法中正确的是
A.在任何物质分子中都含有化学键
B.HF、HCl、HBr、HI的沸点依次升高
C.D2O分子与H2O分子是所含电子总数不相等的分子
D.CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】一滴水约为0.05ml,设室温下水的密度为1g/cm3,则1滴水含水分子数是
A. 3×1022个 B. 1.7×1021个 C. 2×1020个 D. 3×1021个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成细胞的大量元素有( )
A.C、H、O、NB.C、H、O、N、P、S
C.C、H、O、N、Fe、SD.C、H、O、N、P、S、K、Ca、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组选用图所示装置和下列所给试剂来证明非金属性:Cl>I. 
请你按照他们的设计思路完成该实验.
【可供选择的试剂有】
①稀盐酸,②浓硫酸,③MnO2 , ④浓盐酸,⑤淀粉碘化钾溶液,⑥KMnO4 , ⑦NaOH溶液,⑧硝酸银溶液.
烧瓶A中应盛放的药品是(填序号),试管C中应盛放的药品是(填序号),则装置D的作用是 , 当观察到现象 , 即可证明非金属性Cl>I.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种有机物的结构简式为R—CH=CH—COOH,式中的R为烷基,下列关于这种有机物的叙述中错误的是
A.若能溶于水,其水溶液与镁反应能放出氢气
B.可以使溴水和酸性高锰酸钾溶液褪色
C.不能发生加成反应
D.可以与乙醇在一定条件下发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,下列描述合理的是( )
①Zn为负极,Cu为正极
②Cu极上有气泡产生
③阳离子移向Zn极
④电子从Zn极流出沿导线流向Cu极
⑤该装置能将电能转化为化学能
⑥若有0.5mol电子流经导线,则负极质量减轻16g.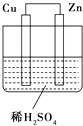
A.①②④
B.②③
C.④⑤⑥
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。

(1)除如图装置所示的实验用品外,还需要的一件实验用品是______________。
(2)圆底烧瓶中所发生反应的离子方程式为___________。
(3)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(4)利用该化学反应,试简述测定反应速率的其他方法:________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。(已知 I2+2 Na2S2O3=== Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(5)表中Vx=__________mL,T1、T2、T3的大小关系是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.常温下,100g46%乙醇水溶液中含有H原子数为12 NA
B.23gNa与足量O2反应,生成Na2O 和Na2O2的混合物,转移的电子数为 NA
C.标准状况下,2.24 LCCl4含有的共价键数为0.4 NA
D.1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017硚口区校级模拟】某兴趣小组为探究外界条件对可逆反应A(g)+B(g)═C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ.然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ.
A | B | C | |
Ⅰ | 0.050molL﹣1 | 0.050molL﹣1 | 0.050molL﹣1 |
Ⅱ | 0.070molL﹣1 | 0.070molL﹣1 | 0.098molL﹣1 |
Ⅲ | 0.060molL﹣1 | 0.060molL﹣1 | 0.040molL﹣1 |
Ⅳ | 0.080molL﹣1 | 0.080molL﹣1 | 0.12molL﹣1 |
针对上述系列实验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol﹣1L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com