
 如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:
如图所示,将Ba(OH)2?8H2O和氯化铵晶体混合后放入试管中,迅速将该试管放入盛有饱和硝酸钾的烧杯中,并用玻璃棒不断搅拌试管中的固体混合物.(已知硝酸钾的溶解度随温度的升高而升高)实验二:将Ba(OH)2?8H2O和氯化铵晶体混合后放入烧杯中,并将烧杯放在事先滴有少量水的玻璃片上.试回答下列问题:

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
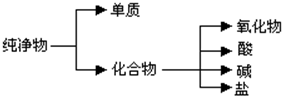 纯净物根据其组成和性质可进行如下分类.
纯净物根据其组成和性质可进行如下分类.| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | H2SO4 或HNO3 H2SO4 或HNO3 |
Ba(OH)2 或KOH Ba(OH)2 或KOH |
BaSO4、Ba(NO3)2、 KNO3、K2SO4(任写一种) BaSO4、Ba(NO3)2、 KNO3、K2SO4(任写一种) |
H2O、NO、NO2、SO2、SO3、BaO、K2O(任写一种) H2O、NO、NO2、SO2、SO3、BaO、K2O(任写一种) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② H2SO4 H2SO4 |
③Ba(OH)2 ④ NaOH NaOH |
⑤Na2CO3 ⑥ K2SO4 K2SO4 |
⑦CO2 ⑧Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
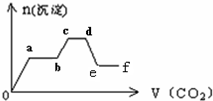 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A、o-a段反应的化学方程式是:Ba(OH)2+CO2=Ba CO3↓+H2O | B、b-c段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- | C、a-b段与c-d段所发生的反应相同 | D、d-e段沉淀的减少是由于碳酸钡固体的消失所致 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省高三第三次月考化学试卷(解析版) 题型:选择题
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是( )

A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2O
B.B~C段反应的离子方程式是2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
C.A~B段与C~D段所发生的反应相同
D.D~E段沉淀的减少是由于碳酸钡固体的消失所致
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高二下学期期中考试化学试题 题型:填空题
(8分)水的电离平衡曲线如图所示。

(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74g,其饱和溶液密度设为1g/mL,其离子积为 。(原子量Ca:40,O:16,H:1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com