
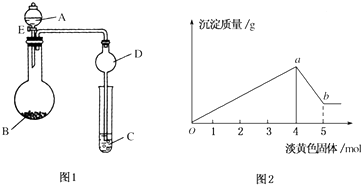
分析 由图可知白色沉淀能部分溶于氢氧化钠,可知沉淀为氢氧化镁和氢氧化铝;横坐标为0-4moL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀为最大值时,该阶段消耗4mol过氧化钠即8molNaOH,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),结合元素守恒n(Mg2+)=n[Mg(OH)2]、n(Al3+)=n[Al(OH)3];横坐标为4-5moL时,发生的化学反应是:Al(OH)3+OH-=AlO2-+2H2O,Al(OH)3完全溶解消耗消耗1moL过氧化钠即2molNaOH,根据消耗的氢氧化钠计算n[Al(OH)3],再根据铝元素守恒可知,n(Al3+)=n[Al(OH)3],据此计算解答.
解答 解:(1)若溶液中有Cu2+会生成蓝色沉淀,有Fe3+会生成红褐色沉淀,题中只有白色沉淀,而且由图可知白色沉淀能部分溶于氢氧化钠,可知沉淀为氢氧化镁和氢氧化铝,所以溶液中的离子为:Mg2+、Al3+.故答案为:Mg2+、Al3+;
(2)横坐标为4-5moL时,发生的化学反应是:Na2O2先与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑,生成的NaOH将Al(OH)3溶解:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;Al(OH)3+OH-=AlO2-+2H2O;
(3)Al(OH)3完全溶解消耗消耗1moL过氧化钠即2molNaOH,由方程式可知n[Al(OH)3]=n(NaOH)=2mol,根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=2mol;
横坐标为0-4moL时发生的化学反应是:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓沉淀为最大值时,该阶段消耗4mol过氧化钠即8molNaOH,根据OH-守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),Mg2+物质的量为1mol,故Mg2+、Al3+的物质的量浓度之比为1:2,故答案为:1:2.
点评 本题考查了离子的存在的分析判断,侧重于考查学生的实验探究能力和分析图象的能力,题目难度中等,注意把握实验原理是解题的关键.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,气体的体积之比等于它们的物质的量之比 | |
| B. | 同温同压下,气体的体积之比等于它们的质量之比 | |
| C. | 同温同压下,相同体积的气体的质量之比等于它们的相对分子质量之比 | |
| D. | 同温同压下,气体的密度之比等于它们的相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管、烧杯 |
| B | 用碱石灰除去氢气中混有的水蒸气并收集氢气 | 洗气瓶、导气管、集气瓶 |
| C | 用氢氧化钠和醋酸溶液测中和反应的中和热 | 烧杯、玻璃棒、温度计 |
| D | 分离苯和苯酚的混合物 | 分液漏斗、烧杯 |
| A. | A | B. | B | C. | C | D. | .D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸性溶液中:K+、Fe2+、Cl-、NO3- | |
| B. | 强碱溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| C. | 强碱性溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 潮湿的空气:N2、O2、CH4、NO2 | |
| B. | 氢氧化铝胶体:Na+、Cu2+、NO3-、MnO4- | |
| C. | 饱和溴水:NH4+、K+、Cl-、C2H5OH | |
| D. | 福尔马林溶液:K+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:
如图是某学生设计的“硫燃烧现象及酸雨危害模拟实验”装置图.实验时操作步骤为:| A. | 可以观察到,硫在氧气中燃烧发出蓝紫色火焰 | |
| B. | 实验结束时,应用注射器向装置中注入NaOH溶液以便更充分地吸收剩余的SO2气体 | |
| C. | A装置中的注射器的作用相当于分液漏斗,可以随时控制反应的发生和停止 | |
| D. | “酸雨”使绿叶变黄,使锌粒、镁片表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com